
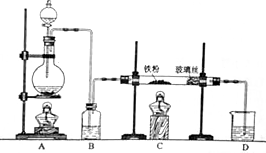
 某研究性学习小组模拟工业生产过程进行试验.请回答下列问题:
某研究性学习小组模拟工业生产过程进行试验.请回答下列问题:
分析 (1)装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;
(2)制取无水氯化亚铁,需要HCl气体,尾气的成分是剩余HCl和生成的氢气,HCl极易溶解于水,缺少防止水蒸汽进入C中装置,氢气不能溶于水;若要制取纯净的FeCl2,需先点燃A处的酒精灯排除装置中的空气,再点燃C处的酒精灯;
(3)从明矾[KAl(SO4)2•12H2O]制备Al、K2SO4和H2SO4的流程:过程①明矾和硫焙烧,4KAl(SO4)2•12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O,气体二氧化硫与氧气在五氧化二矾作催化剂的作用下生成三氧化硫,三氧化硫用98.3%的浓硫酸吸收,SO3+H2O=H2SO4,制得硫酸;过程②焙烧所得固体混合物,用水浸,为提高浸出率,可采取粉碎固体混合物、不断搅拌,从水浸后的滤液中蒸发结晶得到K2SO4晶体,步骤③电解Al2O3,制得Al.
①“焙烧”过程中得到SO2与固体混合物,而固体混合物进行水浸,过滤得到Al2O3与K2SO4,则焙烧”过程中得到SO2、Al2O3、K2SO4,同时有水生成,配平是化学方程式;
②从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤等操作;步骤③为氧化铝电解生成铝和氧气;
③将SO2的利用率转化为KAl(SO4)2•12H2O的利用率,由焙烧”过程中反应方程式,及硫元素守恒,可得关系式:4KAl(SO4)2•12H2O~9H2SO4,据此计算.
解答 解:(1)装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,改变体系内压强,生成气泡或形成水柱是常用的方法,所以图1装置,检查装置的气密性,把B、D中导管下端浸入水中,用洒精灯给烧瓶微热,看到B、D中导管下口有气泡冒出,停止加热后,有一段稳定的水柱,说明装置不漏气,
故答案为:把B、D中导管下端浸入水中,用洒精灯给烧瓶微热,看到B、D中导管下口有气泡冒出,停止加热后,有一段稳定的水柱,说明装置不漏气;
(2)制取无水氯化亚铁,需要HCl气体,故A装置制取的是HCl,反应方程式为:Fe+2HCl$\frac{\underline{\;加热\;}}{\;}$FeCl2+H2,故尾气的成分为未反应的HCl和生成的氢气,由于HCl极易溶于水,故若仍然采用D装置进行尾气处理,很容易造成倒吸,且缺少防止水蒸汽进入C中装置,氢气不溶于水,不利于氢气的吸收,氢气易燃,造成安全隐患,若要制取纯净的FeCl2,需先排净装置中的空气,防止在加热时Fe与O2反应,故先点燃A处的酒精灯,再点燃C处的酒精灯,
故答案为:HCl; 易发生倒吸,缺少防止水蒸汽进入C中装置; 通入氯化氢(赶尽装置中的空气);
(3)①“焙烧”过程中得到SO2与固体混合物,而固体混合物进行水浸,过滤得到Al2O3与K2SO4,则焙烧”过程中得到SO2、Al2O3、K2SO4,同时有水生成,发生反应为:4KAl(SO4)2•12H2O+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+2K2SO4+9SO2↑+48H2O,
故答案为:4KAl(SO4)2•12H2O+3S$\frac{\underline{\;高温\;}}{\;}$2K2SO4+2Al2O3+9SO2↑+48H2O;
②从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤等操作,步骤③为电解氧化铝,氧化铝熔点高,用冰晶石作助熔剂,电解氧化铝生成铝和氧气,反应为:2Al2O3$\frac{\underline{\;\;\;\;\;冰晶石\;\;\;\;\;}}{970℃电解}$4Al+3O2↑,
故答案为:蒸发、结晶;2Al2O3$\frac{\underline{\;\;\;\;\;冰晶石\;\;\;\;\;}}{970℃电解}$4Al+3O2↑;
③设可生产x吨质量分数为98%的硫酸,则:
4KAl(SO4)2•12H2O~9H2SO4,
4×b 9×98
at×96% xt×98% 解得:x=$\frac{216a}{b}$,
故答案为:$\frac{216a}{b}$.
点评 本题以氯化铁以及氯化亚铁、Al、K2SO4和H2SO4制取为载体,考查的是实验室中氯气的制取方法、常见尾气的处理方法以及铁离子的检验等,是对学生综合能力的考查,需要学生具备扎实的基础,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁胶体具有吸附性,可做净水剂 | |
| B. | 该胶体的分散系的分散质粒子的直径大小 是10-9nm-10-7nm之间 | |
| C. | 可用丁达尔效应鉴别氢氧化铁胶体和水 | |
| D. | 可用渗析的方法分离FeCl3溶液和Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)×(10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| C(CO)×(10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 CuCl是应用广泛的有机合成催化剂,可采取不同方法制取.
CuCl是应用广泛的有机合成催化剂,可采取不同方法制取.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
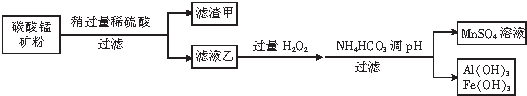
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液 | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL0.1mol•L-1KI溶液,振荡 | 溶液无变化 |
| 然后再滴入1mol•L-1的H2SO4,充分振荡 | 溶液变蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com