
| 1000ρw% |
| M |
| n |
| V |
| 1000ρw% |
| M |
| 1000×1.84×98% |
| 8 |


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
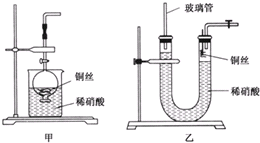
| 浓硝酸 |
| 稀硝酸 |
| 氯气 |
| 硝酸 |
| 空气 |
| 硝酸 |
查看答案和解析>>
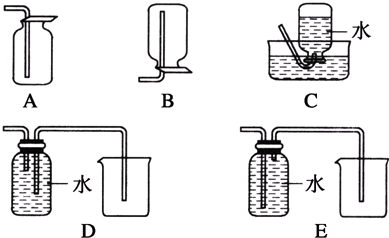
科目:高中化学 来源: 题型:
| … | E | A | B | ||
| C | … | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、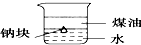 证明ρ(煤油)<ρ(钠)<ρ(水) |
B、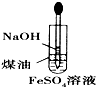 制备Fe(OH)2 |
C、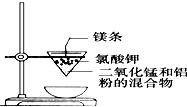 制取金属锰 |
D、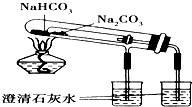 比较NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它们单质的熔、沸点随核电荷数的增加逐渐升高 |
| B、它们单质的颜色随核电荷数的增加逐渐加深 |
| C、它们单质的密度随核电荷数的增加逐渐增大 |
| D、它们氢化物的稳定性核电荷数的增加逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
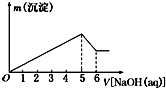 向某硫酸铝和硫酸镁的混合溶液中逐滴加入2mol?L-1的NaOH溶液,生成沉淀的质量m与加入NaOH溶液体积的关系如图所示,则原混合溶液中MgSO4与Al2(SO4)3的物质的量浓度之比为( )
向某硫酸铝和硫酸镁的混合溶液中逐滴加入2mol?L-1的NaOH溶液,生成沉淀的质量m与加入NaOH溶液体积的关系如图所示,则原混合溶液中MgSO4与Al2(SO4)3的物质的量浓度之比为( )| A、1:1 | B、1:2 |
| C、1:3 | D、2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl+Na2CO3;H2SO4+KHCO3 |
| B、BaCl2+Na2SO4;Ba(OH)2+(NH4)2SO4 |
| C、Fe+H2SO4(稀);Fe+CH3COOH(稀) |
| D、NaHCO3(过量)+Ca(OH)2;Ca(HCO3)2+NaOH(过量) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com