
| A. | v(A)=1.8 mol•L-1•s-1 | B. | v(B)=0.3 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(D)=1.6 mol•L-1•s-1 |
科目:高中化学 来源: 题型:选择题
| A. | ①、②、③、④均只有两种结构 | |
| B. | ①的同分异构体数目与④的相同 | |
| C. | ③一定是丙醛 | |
| D. | 若②与④能发生酯化反应,则生成的酯最多有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:Y>Z | |
| B. | X、Y、Z三种元素不可能形成离子化合物 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | Y分别与Z、W形成的化合物中化学键类型不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=4 CH3COOH溶液加水稀释10倍,溶液中各种离子浓度均减小 | |
| B. | 用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至中性,V(CH3COOH溶液)<V(NaOH溶液) | |
| C. | 向0.2 mol•L-1的盐酸溶液中加入等体积0.1 mol•L-1NH3•H2O溶液:c(Cl-)+c(OH-)═c(H+)+c(NH3•H2O) | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)═c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去蛋白质中的葡萄糖,可以用浓硫酸铵溶液盐析过滤方法提纯 | |
| B. | 双氧水中滴加氯化铁溶液立即产生气泡,说明氯化铁的氧化性比过氧化氢强 | |
| C. | 锂钒氧化物蓄电池放电时电池的总反应式为:V2O5+xLi═LixV2O5.供电时Li+向正极移动,充电时阳极的电极反应式为:LixV2O5-xe-═V2O5+xLi+ | |
| D. | 常温下,Mg(OH)2能溶于氯化铵浓溶液的主要原因是NH4+结合OH-使沉淀溶解平衡发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K Na Li | B. | Al Mg Na | C. | N O C | D. | Cl S P |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某种核素的相对原子质量的近似值 | B. | 某种核素的相对原子质量 | ||
| C. | 某种元素的相对原子质量的近似值 | D. | 某种元素的相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
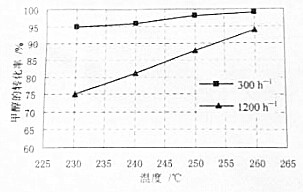 以高纯H2燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向.
以高纯H2燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com