
ÓɶĢÖÜĘŚŌŖĖŲ×é³ÉµÄµ„ÖŹA”¢B”¢CŗĶ¼×”¢ŅŅ”¢±ū”¢¶”ĖÄÖÖ»ÆŗĻĪļÓŠĶ¼Ź¾µÄ×Ŗ»»¹ŲĻµ£¬ŅŃÖŖCĪŖĆܶČ×īŠ”µÄĘųĢ壬¼×ŹĒµē½āÖŹ£®
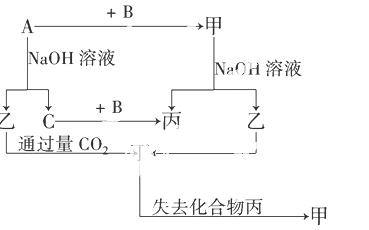
øł¾ŻĶ¼Ź¾×Ŗ»Æ¹ŲĻµ»Ų“š£ŗ
£Ø1£©Š“³öĻĀĮŠĪļÖŹµÄ»ÆѧŹ½£ŗ
A________ _£¬B_________£¬ŅŅ_________£¬¶”_________”£
_£¬B_________£¬ŅŅ_________£¬¶”_________”£
£Ø2£©×é³Éµ„ÖŹAµÄŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒ__________£¬±ūµÄµē×ÓŹ½ŹĒ________”£
£Ø3£©Š“³öĻĀĮŠ·½³ĢŹ½£ŗ
¢ŁAÓėNaOHČÜŅŗ·“Ó¦µÄ»Æѧ·½³ĢŹ½____________________________________”£
¢ŚŅŅÓė¹żĮæCO2·“Ó¦µÄĄė×Ó·½³ĢŹ½______________________________________”£

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŃŠ¾æµŖµÄ¹Ģ¶Ø¾ßÓŠÖŲŅŖŅāŅ唣
£Ø1£©Ą×ÓźĢģĘųÖŠ·¢Éś×ŌČ»¹ĢµŖŗ󣬵ŖŌŖĖŲ×Ŗ»ÆĪŖ________¶ų“ęŌŚÓŚĶĮČĄÖŠ”£“¦ÓŚŃŠ¾æ½×¶ĪµÄ»Æѧ¹ĢµŖŠĀ·½·ØŹĒN2ŌŚ“߻ƼĮ±ķĆęÓėĖ®·¢ÉśČēĻĀ·“Ó¦£ŗ
2N2(g)+6H2O(l)=4NH3(g)+3O2(g) ”÷H K ¢Ł
ŅŃÖŖ£ŗN2(g)+3H2(g)=2NH3(g) ”÷H1=-92.4kJ”¤mol-1 K1 ¢Ś
2H2(g) +O2(g) =2H2O(l) ”÷H2=-571.6kJ”¤mol-1 K2 ¢Ū
Ōņ”÷H =________£»K=___________£ØÓĆK1ŗĶ K2±ķŹ¾£©”£
£Ø2£©ŌŚĖÄøöČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ£¬·Ö±š³äČė1mol N2”¢3mol H2O£¬ŌŚ“߻ƼĮĢõ¼žĻĀ½ųŠŠ·“Ó¦¢Ł3h£¬ŹµŃ鏿¾Ż¼ūĻĀ±ķ£ŗ
| ŠņŗÅ | µŚŅ»×é | µŚ¶ž×é | µŚČż×é | µŚĖÄ×é |
| t/”ę | 30 | 40 | 50 | 80 |
| NH3Éś³ÉĮæ/£Ø10©6mol£© | 4.8 | 5.9 | 6.0 | 2.0 |
ĻĀĮŠÄÜĖµĆ÷·“Ó¦¢Ł“ļµ½Ę½ŗāדĢ¬µÄŹĒ_____£ØĢī×ÖÄø£©”£
a.NH3ŗĶO2µÄĪļÖŹµÄĮæÖ®±ČĪŖ4”Ć3
b.·“Ó¦»ģŗĻĪļÖŠø÷×é·ŻµÄÖŹĮæ·ÖŹż²»±ä
c.µ„Ī»Ź±¼äÄŚĆæĻūŗÄ1molN2µÄĶ¬Ź±Éś³É2molNH3
d.ČŻĘ÷ÄŚĘųĢåĆÜ¶Č²»±ä
ČōµŚČż×é·“Ó¦3hŗóŅŃ“ļĘ½ŗā£¬µŚČż×éN2µÄ×Ŗ»ÆĀŹĪŖ___________£»µŚĖÄ×é·“Ó¦ÖŠŅŌNH3±ķŹ¾µÄ·“Ó¦ĖŁĀŹŹĒ__________________£¬ÓėĒ°Čż×éĻą±Č£¬NH3Éś³ÉĮæ×īŠ”µÄŌŅņæÉÄÜŹĒ__________________________________________”£
£Ø3£©ĆĄ¹ś»Æѧ¼Ņ·¢Ć÷Ņ»ÖÖŠĀŠĶ“߻ƼĮæÉŅŌŌŚ³£ĪĀĻĀŗĻ³É°±£¬½«Ęäø½×ÅŌŚµē³ŲµÄÕżøŗ¼«ÉĻŹµĻÖµŖµÄµē»Æѧ¹Ģ¶Ø£¬Ęä×°ÖĆŹ¾ŅāĶ¼ČēĻĀ£ŗ
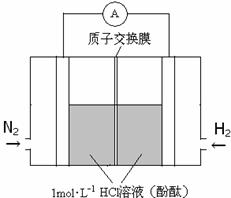
ŌņæŖŹ¼½×¶ĪÕż¼«·“Ó¦Ź½ĪŖ_____________£»ŗöĀŌµē½ā¹ż³ĢÖŠČÜŅŗĢå»ż±ä»Æ£¬µ±µē³ŲÖŠŅõ¼«ĒųČÜŅŗpH = 7Ź±£¬ČÜŅŗÖŠNH3”¤H2OµÄÅضČĪŖ___________( Kb=2”Į10-5mol”¤L-1)£»µ±µē³ŲÖŠŅõ¼«Ēų³ŹŗģÉ«Ź±£¬ČÜŅŗÖŠĄė×ÓÅضČÓɓ󵽊”µÄĖ³ŠņĪŖ_________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Įņ“śĮņĖįÄĘ(Na2S2O3)ŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤²śĘ·”£Ä³ŠĖȤŠ”×éÄāÖʱøĮņ“śĮņĖįÄĘ¾§Ģå(Na2S2O3·5H2O)”£
¢ń.”¾²éŌÄ׏ĮĻ”æ
(1)Įņ“śĮņĖįÄĘ(Na2S2O3)Ņ×ČÜÓŚĖ®£¬ŌŚÖŠŠŌ»ņ¼īŠŌ»·¾³ÖŠĪČ¶Ø£¬ŹÜČČ”¢ÓöĖįŅ×·Ö½ā”£
(2)Na2S2O3·5H2OŹĒĪŽÉ«ĶøĆ÷¾§Ģ壬Ņ×ČÜÓŚĖ®£¬ĘäĻ”ČÜŅŗÓėBaCl2ČÜŅŗ»ģŗĻĪŽ³ĮµķÉś³É”£
(3)ĻņNa2CO3ŗĶNa2S»ģŗĻČÜŅŗÖŠĶØČėSO2æÉÖʵĆNa2S2O3£Ø·“Ó¦·½³ĢŹ½ĪŖ£ŗ2Na2S£«Na2CO3£« 4SO2===3Na2S2O3£«CO2£©£¬ĖłµĆ²śĘ·³£ŗ¬ÓŠÉŁĮæNa2SO3ŗĶNa2SO4”£
¢ņ.”¾Öʱø²śĘ·”æŹµŃé×°ÖĆČēĶ¼ĖłŹ¾£ŗ
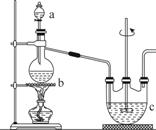

Ēė»Ų“šĻĀĮŠĪŹĢā:
(1)ŹµŃé²½Öč£ŗ¼ģ²é×°ÖĆĘųĆÜŠŌŗó£¬ĻņČż¾±ĘæcÖŠ¼ÓČėNa2CO3ŗĶNa2SµÄ»ģŗĻČÜŅŗ£¬ŌŁ½«·ÖŅŗĀ©¶·aÖŠŅŗĢåµĪ¼Óµ½ÉÕĘæbÖŠ¼ÓČČ·¢Éś·“Ó¦²śÉśSO2£¬ĒėŠ“³öbÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½______________________”£“żNa2SŗĶNa2CO3ĶźČ«ĻūŗÄŗ󣬽įŹų·“Ó¦”£¹żĀĖcÖŠµÄ»ģŗĻĪļ£¬ĀĖŅŗ¾____________________(ĢīŠ“²Ł×÷Ćū³Ę)”¢¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ”¢µĆµ½²śĘ·”£
(2) ×°ÖĆAÓĆÓŚ“¦ĄķĪ²Ęų£¬æÉŃ”ÓƵÄ×īŗĻĄķ×°ÖĆ(¼Š³ÖŅĒĘ÷ŅŃĀŌČ„)ĪŖ________(ĢīŠņŗÅ)”£
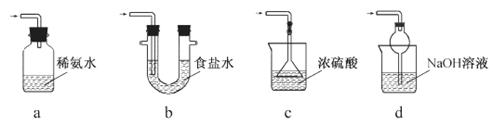
(3)ĪŖĮĖ±£Ö¤Įņ“śĮņĖįÄĘµÄ²śĮ棬ŹµŃéÖŠĶØČėµÄSO2²»ÄܹżĮ棬ŌŅņŹĒ_________”£
III.”¾²ā¶Ø²śĘ·“æ¶Č”æ
×¼Č·³ĘČ”W g²śĘ·£¬ÓĆŹŹĮæÕōĮóĖ®Čܽā£¬ŅŌµķ·Ū×÷ÖøŹ¾¼Į£¬ÓĆ0.100 0 mol·L£1µāµÄ±ź×¼ČÜŅŗµĪ¶Ø”£
·“Ó¦ŌĄķĪŖ2S2O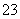 £«I2===S4O
£«I2===S4O £«2I££ØŗöĀŌNa2SO3ÓėI2·“Ó¦£©
£«2I££ØŗöĀŌNa2SO3ÓėI2·“Ó¦£©
(4)µĪ¶ØÖĮÖÕµćŹ±£¬ČÜŅŗŃÕÉ«µÄ±ä»Æ£ŗ_________________________________”£
(5)µĪ¶ØĘšŹ¼ŗĶÖÕµćµÄŅŗĆęĪ»ÖĆČēĶ¼£¬Ōņ²śĘ·µÄ“æ¶ČĪŖ(ÉčNa2S2O3·5H2OĻą¶Ō·Ö×ÓÖŹĮæĪŖM)______________”£
IV.”¾Ģ½¾æÓė·“Ė¼”æ
(6)ĪŖŃéÖ¤²śĘ·ÖŠŗ¬ÓŠNa2SO3ŗĶNa2SO4£¬øĆŠ”×éÉč¼ĘĮĖŅŌĻĀŹµŃé·½°ø£¬Ēė½«·½°ø²¹³äĶźÕū”£(ĖłŠčŹŌ¼Į“ÓĻ”HNO3”¢Ļ”H2SO4”¢Ļ”ŃĪĖį”¢ÕōĮóĖ®ÖŠŃ”Ōń)
Č”ŹŹĮæ²śĘ·Åä³ÉĻ”ČÜŅŗ£¬µĪ¼Ó×ćĮæBaCl2ČÜŅŗ£¬ÓŠ°×É«³ĮµķÉś³É£¬ __________________£¬Čō³ĮµķĪ“ĶźČ«Čܽā£¬²¢ÓŠ“Ģ¼¤ŠŌĘųĪ¶µÄĘųĢå²śÉś£¬ŌņæÉČ·¶Ø²śĘ·ÖŠŗ¬ÓŠNa2SO3ŗĶNa2SO4”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÓŠ»śĪļAµÄ²śĮæŹĒŗāĮæŅ»øö¹ś¼ŅŹÆÓĶ¹¤Ņµ·¢Õ¹Ė®Ę½µÄ±źÖ¾£¬æÉ·¢ÉśŅŌĻĀĻµĮŠ×Ŗ»Æ£¬B”¢DŹĒÉś»īÖŠ³£¼ūµÄĮ½ÖÖÓŠ»śĪļ£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
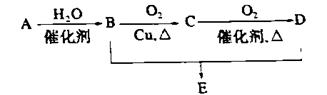
A.AµÄ½į¹¹¼ņŹ½ĪŖCH2= CH2
B.1mol BĪļÖŹæÉŅŌÓė×ćĮæNa·“Ӧɜ³É0.5mol H2
C.B”¢D”¢EČżÖÖĪļÖŹæÉŅŌÓƱ„ŗĶNa2CO3ČÜŅŗ¼ų±š
D.ÓÉB”¢DÖʱøEÅØH2SO4Ö»×÷ĪüĖ®¼Į
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠ½ā ŹĶŹĀŹµµÄ·½³ĢŹ½²»ÕżČ·µÄŹĒ£Ø £©
ŹĶŹĀŹµµÄ·½³ĢŹ½²»ÕżČ·µÄŹĒ£Ø £©
A£®²ā0.1mol/L°±Ė®µÄpHĪŖ11£ŗNH3·H2O NH4++OH-
NH4++OH-
B£®½«Naæé·ÅČėĖ®ÖŠ£¬²śÉśĘųĢå£ŗ2Na+2H2O=2NaOH+H2”ü
C£®ÓĆCuCl2ČÜŅŗ×öµ¼µēŹµŃ飬µĘÅŻ·¢¹ā£ŗCuCl2 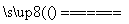 Cu2++2Cl-
Cu2++2Cl-
D£®AlʬČÜÓŚNaOHČÜŅŗÖŠ£¬²śÉśĘųĢå£ŗ2Al+2OH-+2H2O=2AlO2-+3H2”ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠ¹ŲÓŚĀĮµÄŠšŹöÖŠÕżČ·µÄŹĒ (””””)
A£®ĀĮ»¹ŌŠŌĒæĒŅĒ×ŃõŠŌĒ棬ĖłŅŌæÉĶعżĀĮČČ·“Ó¦Ņ±Į¶øßČŪµć½šŹō
B£®ĀĮŌŚæÕĘųÖŠ¼«Ņ׊āŹ“£¬ĖłŅŌĀĮÖĘĘ·µÄŹ¹ÓĆŹ±¼äŗܶĢ
C£®ĀĮÄÜÄĶĻ”ĮņĖįøÆŹ“£¬ĖłŅŌŌĖĖĶĻ”ĮņĖįæÉÓĆĀĮÖĘ²Ū³µ
D£®ĀĮµÄµ¼µēŠŌ±ČĶ”¢ŅųøüĒ棬ĖłŅŌ³£ÓĆŅŌÖĘŌģµēĻß”¢µēĄĀ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
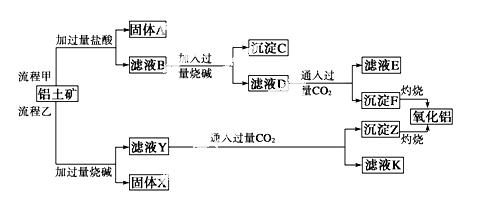
“ÓĀĮĶĮæó(Ö÷ŅŖ³É·ÖŹĒAl2O3£¬ŗ¬SiO2”¢Fe2O3”¢MgOµČŌÓÖŹ)ÖŠĢįČ”Ńõ»ÆĀĮµÄĮ½ÖÖ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Į÷³Ģ¼×¼ÓČėŃĪĖįŗóÉś³ÉAl3£«µÄĄė×Ó·½³ĢŹ½ĪŖ_____________________________________”£
£Ø2£©Į÷³ĢŅŅ¼ÓČėÉÕ¼īŗóÉś³ÉSiO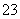 µÄĄė×Ó·½³ĢŹ½ĪŖ___________________________”£
µÄĄė×Ó·½³ĢŹ½ĪŖ___________________________”£
£Ø3£©ŃéÖ¤ĀĖŅŗBÖŠŗ¬Fe3£«£¬æÉȔɣĮæĀĖŅŗ²¢¼ÓČė________(ĢīŹŌ¼ĮĆū³Ę)”£
£Ø4£©ĀĖŅŗE”¢KÖŠČÜÖŹµÄÖ÷ŅŖ³É·ÖŹĒ__________(Ģī»ÆѧŹ½)£¬Š“³öøĆČÜŅŗµÄŅ»ÖÖÓĆĶ¾£ŗ___________”£
£Ø5£©ŅŃÖŖ298 KŹ±£¬Mg(OH)2µÄČܶȻż³£ŹżKsp£½5.6”Į10£12£¬Č”ŹŹĮæµÄĀĖŅŗB£¬¼ÓČėŅ»¶ØĮæµÄÉÕ¼ī“ļµ½³ĮµķČܽāĘ½ŗā£¬²āµĆpH£½13.00£¬Ōņ“ĖĪĀ¶ČĻĀ²ŠĮōŌŚČÜŅŗÖŠµÄc( Mg2£«)£½__________”£
Mg2£«)£½__________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
³£ĪĀĻĀ£¬Ä³ĪŽÉ«ĶøĆ÷µÄČÜŅŗÖŠ£¬ĻĀĮŠø÷×éĄė×ÓÄܹ»“óĮæ¹²“ęµÄŹĒ
A£®H£«”¢Na£«”¢Cl£”¢CO32£ B£® Ba2£«”¢Na£«”¢SO42£”¢Cl£
C£®MnO4£”¢K£«”¢I£”¢H£« D£® Mg2£«”¢Cl£”¢NO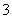 ”¢H£«
”¢H£«
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
A”¢B”¢CĪŖ֊ѧ³£¼ūµ„ÖŹ£¬ĘäÖŠŅ»ÖÖĪŖ½šŹō£¬Ķس£ĒéæöĻĀ£¬AĪŖ¹ĢĢ壬BĪŖ»ĘĀĢÉ«ĘųĢ壬CĪŖĪŽÉ«ĘųĢ唣D”¢E”¢F”¢G”¢H”¢X¾łĪŖ»ÆŗĻĪļ£¬ĘäÖŠX³£ĪĀĻĀŹĒĪŽÉ«ĘųĢ壬ĘäĖ®ČÜŅŗŹĒŅ»ÖÖĒæĖį£¬EĪŖŗŚÉ«¹ĢĢ壬HŌŚ³£ĪĀĻĀĪŖŅŗĢ唣ĖüĆĒÖ®¼äµÄ×Ŗ»Æ¹ŲĻµČēĻĀĶ¼ĖłŹ¾(Ęä֊ijŠ©·“Ó¦Ģõ¼žŗĶ²æ·Ö·“Ó¦ĪļŅŃĀŌČ„)”£
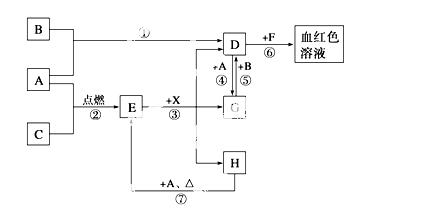
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Š“³öĻĀĮŠĪļÖŹµÄ»ÆѧŹ½£ŗA__________”¢D__________”¢E__________”¢X_________”£
£Ø2£©ŌŚ·“Ó¦¢Ł”«¢ßÖŠ£¬²»ŹōÓŚŃõ»Æ»¹Ō·“Ó¦µÄŹĒ__________(Ģī±ąŗÅ)”£
£Ø3£©·“Ó¦¢ÜµÄĄė×Ó·½³ĢŹ½ŹĒ_____________________________________________£»
£Ø4£©·“Ó¦¢ßµÄ»Æѧ·½³ĢŹ½ŹĒ_____________________________________________£»
øĆ·“Ó¦ÖŠĆæĻūŗÄ0.3 molµÄA£¬æÉ×ŖŅʵē×Ó______mol”£
£Ø5£©Š“³öDµÄČÜŅŗÓėŠ”ĖÕ“ņČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ________________________
 _____________________________________________________________________ӣ
_____________________________________________________________________ӣ
£Ø6£©³żČ„DČÜŅŗÖŠ»ģÓŠµÄÉŁĮæGµÄ·½·ØŹĒ_________________________________
_____________________________________________________________________ӣ
£Ø7£©ŌŚDČÜŅŗÖŠÖʱøĪŽĖ®D¹ĢĢåµÄ·½·ØŹĒ__________________________________
_____________________________________________________________________ӣ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com