
| A. | 甲醇,乙醇 | B. | 乙醇,1-丙醇 | C. | 2-丙醇和1-丁醇 | D. | 无法判断 |
分析 饱和一元醇与钠按物质的量比1:1反应,生成的H2在标准状况下的体积为5.6L,则氢气的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,故需要金属Na的物质的量为0.5mol,参加反应的钠的质量为0.5mol×23g/mol=11.5g<13.8g,故醇完全反应,计算醇的平均相对分子质量,结合两种醇分子中相差一个碳原子计算确定碳原子数目.
解答 解:生成的H2在标准状况下的体积为5.6L,则氢气的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,故需要金属Na的物质的量为0.5mol,参加反应的钠的质量为0.5mol×23g/mol=11.5g<13.8g,故醇完全反应,
饱和一元醇与钠按物质的量比1:1反应,则饱和一元醇的总物质的量为0.5mol,故饱和一元醇混合物的平均相对分子质量=$\frac{18.8}{0.5}$=37.6,由于两种醇分子中相差一个碳原子,设醇中碳原子数目分别为n、n+1,则:
14n+2+16<37.6且12(n+1)+2(n+1)+2+16>37.6,联立可得n=1,
故选A.
点评 本题考查有机物的推断,属于计算型推断,理解掌握醇与钠反应,关键是进行过量计算判断醇完全反应,注意平均相对分子质量的应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 △H=+88.6kJ/mol
△H=+88.6kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:选择题
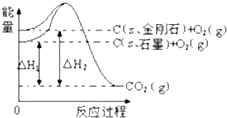
| A. | 石墨转化为金刚石需吸热 | B. | 石墨和金刚石的转化是物理变化 | ||
| C. | 金刚石的稳定性强于石墨 | D. | 石墨和金刚石是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 在某有机物A的分子中,具有酚羟基、醇羟基、羧基等官能团,其结构简式如图.
在某有机物A的分子中,具有酚羟基、醇羟基、羧基等官能团,其结构简式如图.

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池中,负极上发生的反应是还原反应 | |
| B. | 原电池中,电流的方向是负极-导线-正极 | |
| C. | 双液原电池中的盐桥是为了联通电路,所以也可以用金属导线代替 | |
| D. | 在原电池中,阳离子移向正极,阴离子移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水银温度计不慎被打破,用胶头滴管将水银吸出放入水封的瓶中,残破的温度计插入装有硫粉在广口瓶中 | |
| B. | 用氢气还原氧化铜的实验中,开始应该先点燃酒精灯后通氢气 | |
| C. | 遇到氯气泄漏时,应立即关闭氯气罐,用浸湿食盐水的毛巾捂住口鼻顺风跑至安全处 | |
| D. | 乘坐火车时,严禁携带白磷、汽油、氯化钠等易燃易爆物品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
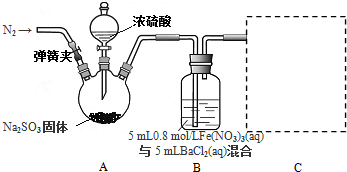
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com