
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均 浓度如下表:
浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/mol.L | 4x10-6 | 6x10-6 | 2x10-5 | 4x10-5 | 3x10-5 | 2x10-5 |
根据表中数据判断PM2.5的酸碱性为____________,
⑵ ①将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g)=H2O(g)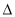 H=-241.8KJ/mol
H=-241.8KJ/mol
C(s)+1/2O2(g)=CO(g)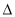 H=-110.5KJ/mol
H=-110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式_______________________;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是_________________
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为______________
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年安徽省高二上期中化学试卷(解析版) 题型:填空题
I.“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛.生产煤炭气的反应之一是:C(s)+H2O(g) CO(g)+H2(g) △H=+131.4kJ/mol
CO(g)+H2(g) △H=+131.4kJ/mol
(1)在容积为3L的密闭容器中发生上述反应,5min后容器内气体的密度增大了0.12g/L,用H2O表示0~5min的平均反应速率为 。
(2)关于上述反应在化学平衡状态时的描述正确的是 .
A.CO的含量保持不变 B.v正(H2O)=v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在图中继续画出t1时刻之后正反应速率随时间的变化:

①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示)。
(4)在一定条件下用CO和H2可以制得甲醇(化学式为CH3OH),CH3OH和CO的燃烧热分别为725.8kJ/mol,283.0kJ/mol,1molH2O(l)变为H2O(g)吸收44.0 kJ的热量,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式 。
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡常数表达式为: ,它所对应的化学方程式为 。
,它所对应的化学方程式为 。
(2)已知在400℃时,N2(g)+3H2(g)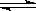 2NH3(g)△H<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
2NH3(g)△H<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
A、缩小体积增大压强 B、升高温度 C、加催化剂 D、使氨气液化移走
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上期中化学试卷(解析版) 题型:选择题
化合物 X是一种医药中间体,其结构简式如图所示,下列有关化合物 X的说法正确的是

A.分子中两个苯环一定处于同一平面
B.不能与饱和 Na2CO3溶液反应
C.在酸性条件下水解,水解产物只有一种
D.1 mol化合物X最多能与2 molNaOH反应
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省瓦房店市高三上10月月考化学试卷(解析版) 题型:选择题
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
A.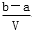 mol·L-1 B.
mol·L-1 B.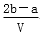 mol·L-1
mol·L-1
C.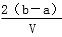 mol·L-1 D.
mol·L-1 D. mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省瓦房店市高三上10月月考化学试卷(解析版) 题型:选择题
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列分析正确的是
A.上述实验条件下,物质的氧化性:Cu2+ > I2 > SO2
B.通入SO2时,SO2与I2反应,I2作还原剂
C.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
D.滴加KI溶液,转移2 mol e- 时生成1 mol白色沉淀
查看答案和解析>>
科目:高中化学 来源:2016-2017学年青海省高二上月考一化学卷(解析版) 题型:填空题
(1)把0.6molX气体和0.4molY气体混合于2L容器中,使它们发生如下反应:3X(g)+Y(g) nZ(g)+2W(g)经过5min后,反应生成0.2molW,并测得以Z浓度变化表示的反应速率为0.01mol·L-1·min-1。则上述反应中Z的化学计量数n的值是 。
nZ(g)+2W(g)经过5min后,反应生成0.2molW,并测得以Z浓度变化表示的反应速率为0.01mol·L-1·min-1。则上述反应中Z的化学计量数n的值是 。
(2)可逆反应2A(g)+B(g) 2C(g)+2D(g),取amolA和bmolB置于VL容器中,1min后,测得容器内A的浓度为xmol/L,这时B的浓度为 ,C的浓度为 。这段时间内反应的平均反应速率
2C(g)+2D(g),取amolA和bmolB置于VL容器中,1min后,测得容器内A的浓度为xmol/L,这时B的浓度为 ,C的浓度为 。这段时间内反应的平均反应速率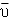 (A)= 。
(A)= 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年青海省高二上月考一化学卷(解析版) 题型:选择题
在一定条件下,充分燃烧一定量的丁烷放出热量Q kJ(Q>0),经测定完全吸收生成的CO2需消耗 5 mol·L-1 KOH溶液100 mL,恰好生成正盐,则此条件下反应C4H10(g)+13/2O2(g)= 4CO2(g)+5H2O(g)的ΔH为( )
A.+8 Q kJ·mol-1 B.+16 Q kJ·mol-1
C.-8 Q kJ·mol-1 D.-16 Q kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高一上半期考试化学卷(解析版) 题型:填空题
(1)某气态氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为____________,R的相对原子质量为____________。
(2)已知CO、CO2的混合气体的质量为15 g,在标准状况下体积为8.8 L,则可推知该混合气体中含CO________ g,所含CO2在标准状况下体积为____________ L。
(3)将4 g NaOH溶于____________g水中,才能使每100个水分子中溶有1个Na+。
(4)同温同压下SO2 与 He密度之比为 ,若质量相等,两种气体的体积之比____________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上期中化学卷(解析版) 题型:填空题
银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
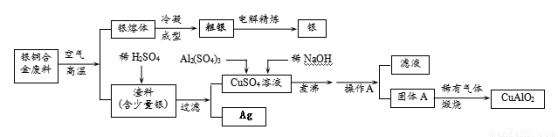
(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 mol•L—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com