
| A. | 硫酸、烧碱、氯酸钾、过氧化钠分别属于酸、碱、盐、碱性氧化物 | |
| B. | PM2.5指大气中直径接近于2.5×10-6 m的颗粒物,PM2.5在空气中形成胶体 | |
| C. | 氯气的水溶液能导电,因此氯气属于电解质 | |
| D. | 反应8NH3+3Cl2═N2+6NH4Cl中,氧化剂与还原剂物质的量之比是3:2 |
分析 A.碱性氧化物是和酸反应生成盐和水的氧化物,过氧化钠属于过氧化物,水溶液中电离出的阳离子全部是氢离子的化合物为酸,水溶液中电离出的阴离子全部是氢氧根离子的化合物为碱,金属阳离子和酸根阴离子构成的化合物为盐;
B.胶体的分散系中分散质的直径在1~100nm;
C.电解质是在水溶液中或熔融状态下能导电的化合物,根据定义判断;
D.反应3Cl2+8NH3═N2+6NH4Cl中,Cl元素化合价降低,被还原,Cl2为氧化剂,N元素化合价升高,被氧化,NH3为还原剂.
解答 解:A.硫酸是酸,烧碱是氢氧化钠属于碱,氯酸钾属于盐,过氧化钠为过氧化物,与酸反应生成盐、气体,不符合碱性氧化物概念,不是碱性氧化物,故A错误;
B.胶体的分散系中分散质的直径在1~100nm,PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,直径大于100nm,则细颗粒物分散在空气中形成的分散系不是胶体,故B错误;
C.氯气是非金属单质,不属于电解质,氯水导电是因为氯气和水反应生成的氯化氢、次氯酸是电解质,氯气本身不能电离出离子,故C错误;
D.反应中Cl2为氧化剂,NH3为还原剂,由方程式可知,当有8molNH3参加反应,有2mol被氧化,则该反应中氧化剂与还原剂的物质的量之比为3:2,故D正确.
故选D.
点评 本题考查了物质的分类、胶体性质、电解质的概念、氧化还原反应的分析判断,明确概念实质是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
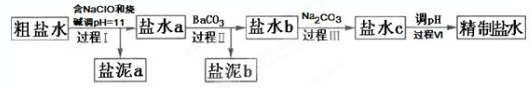
| Ca(OH)2 | Mg(OH)2 | |
| pH | ≥11.5 | ≥4.2 |
| A. | 盐泥a除泥沙外,还含有Ca(OH)2和Mg(OH)2 | |
| B. | 过程Ⅰ中NH4+转化为N2的离子方程式是3ClO-+2NH4+═3Cl-+N2↑+3H2O+2H+ | |
| C. | 过程Ⅱ中通入CO2有利于除SO42- | |
| D. | 过程Ⅳ调pH可以使用硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
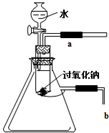 用脱脂棉包住0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | SiO2与NaOH溶液反应:SiO2+2OH-═SiO32-+H2O | |
| D. | 将氯气通入水中:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | K2SO4、HNO3、BaCl2 | B. | NaOH、NaCl、CuCl2 | ||
| C. | BaCl2、Na2CO3、HCl | D. | KCl、H2SO4、AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,CH3CH(C2H5)CH(C2H5)CH3的名称是2,3-二乙基丁烷 | |
| B. | 等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量不相等 | |
| C. | 通过石油裂解可以得到乙烯、丙烯、甲烷、苯、甲苯等重要化工基本原料 | |
| D. | 用Na2CO3溶液能区分CH3COOH、CH3CH2OH、苯、硝基苯四种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13.3% | B. | 26.6% | C. | 20% | D. | ≥20% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com