
分析 (1)①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1453kJ•mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③CO(g)+2H2(g)═CH3OH(l)△H=-128.1kJ•mol-1.
盖斯定律③-②+①×$\frac{1}{2}$计算CO(g)燃烧热;
(2)①化学平衡常数是指一定温度下,当一个可逆反应达到化学平衡时,生成物浓度系数之幂的积与反应物浓度系数之幂的积比值,吸附小分子的肌红蛋白(MbX)的个数等于生成MbX的个数,由k=$\frac{c(MbX)}{c(Mb)\frac{P}{{P}_{0}}}$可得c(Mb)=$\frac{c(MbX)}{K\frac{P}{{P}_{0}}}$,吸附小分子的肌红蛋白(MbX)占总肌红蛋白的比例等于$\frac{c(MbX)}{c(Mb)+c(MbX)}$=$\frac{c(MbX)}{\frac{c(MbX)}{K}\frac{P}{{P}_{0}}+c(MbX)}$=$\frac{K\frac{P}{{P}_{0}}}{K\frac{P}{{P}_{0}}+1}$;
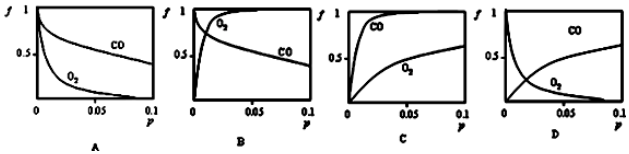
②增大压强,平衡正向移动,因此无论是CO还是O2,随着压强的增大,结合率(f)都是逐渐增大.在常温下,肌红蛋白与CO结合反应的平衡常数K(CO)远大于与O2结合的平衡常数K(O2),说明肌红蛋白与CO的结合能力比其与O2的结合能力强,所以相同压强条件下,肌红蛋白与CO的结合率(f)更大;
③已知:①Hb(aq)+H+(aq)?HbH+(aq);△H1,K1
②HbH+(aq)+O2(g)?HbHO2(aq)+H+;△H2,K2
由盖斯定律可知:①+②可得Hb(aq)+O2(g)?HbO2(aq)△H,
因此△H=△H1+△H2,K=K1•K2;
反应Hb(aq)+O2(g)?HbO2(aq),△S<0,由△G=△H3-T•△S<0自发可知,低温下反应③能自发进行,说明△H3<0;
(3)将少量CO2气体通入石灰乳中充分反应,达到平衡后发生的反应为:Ca2++CO32-?CaCO3+2OH-,平衡常数K=$\frac{{c}^{2}(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=$\frac{{c}^{2}(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$×$\frac{c(C{a}^{2+})}{c(C{a}^{2+})}$=$\frac{Ksp(Ca(OH)_{2})}{Ksp(CaC{O}_{3})}$,据此计算碳酸根离子浓度.
解答 解:(1)①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1453kJ•mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③CO(g)+2H2(g)═CH3OH(l)△H=-128.1kJ•mol-1.
盖斯定律③-②+①×$\frac{1}{2}$计算CO(g)燃烧热的热化学方程式为:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ•mol-1.
故答案为:283;
(2)①Mb(aq)+X(g)?MbX(aq)的化学平衡常数K=$\frac{c(MbX)}{c(Mb)+c(MbX)}$=$\frac{c(MbX)}{c(Mb)\frac{P}{{P}_{0}}}$=$\frac{c(MbX){P}_{0}}{c(Mb)P}$;
吸附小分子的肌红蛋白(MbX)的个数等于生成MbX的个数,由k=$\frac{c(MbX)}{c(Mb)\frac{P}{{P}_{0}}}$可得c(Mb)=$\frac{c(MbX)}{c(Mb)\frac{P}{{P}_{0}}}$,吸附小分子的肌红蛋白(MbX)占总肌红蛋白的比例等于$\frac{c(MbX)}{c(Mb)+c(MbX)}$=$\frac{c(MbX)}{\frac{c(MbX)}{K}\frac{P}{{P}_{0}}+c(MbX)}$=$\frac{K\frac{P}{{P}_{0}}}{K\frac{P}{{P}_{0}}+1}$=$\frac{PK}{PK+1}$;
故答案为:$\frac{c(MbX){P}_{0}}{c(Mb)P}$;$\frac{PK}{PK+1}$;
②对于Mb(aq)+X(g)?MbX(aq),增大压强,平衡正向移动,因此无论是CO还是O2,随着压强的增大,结合率(f)都是逐渐增大.在常温下,肌红蛋白与CO结合反应的平衡常数K(CO)远大于与O2结合的平衡常数K(O2),说明肌红蛋白与CO的结合能力比其与O2的结合能力强,所以相同压强条件下,肌红蛋白与CO的结合率(f)更大,因此C图象符合,
故选C,
故答案为:C;
③已知:①Hb(aq)+H+(aq)?HbH+(aq);△H1,K1
②HbH+(aq)+O2(g)?HbHO2(aq)+H+;△H2,K2
由盖斯定律可知:①+②可得Hb(aq)+O2(g)?HbO2(aq)△H,
因此△H=△H1+△H2,K=K1•K2;
反应Hb(aq)+O2(g)?HbO2(aq),△S<0,由△G=△H3-T•△S<0自发可知,低温下反应③能自发进行,说明△H3<0;
故答案为:K1•K2;<;<;
(3)将少量CO2气体通入石灰乳中充分反应,达到平衡后发生的反应为:Ca2++CO32-?CaCO3+2OH-,平衡常数K=$\frac{{c}^{2}(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=$\frac{{c}^{2}(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$×$\frac{c(C{a}^{2+})}{c(C{a}^{2+})}$=$\frac{Ksp(Ca(OH)_{2})}{Ksp(CaC{O}_{3})}$,达到平衡后,测得溶液c(OH-)=c mol•L-1,则c(CO32-)=$\frac{a{c}^{2}}{b}$mol/L,
故答案为:$\frac{a{c}^{2}}{b}$.
点评 本题考查了化学平衡常数的计算、化学平衡的移动、反应热的计算、化学反应进行的方向等问题,综合性很强,题目难度中等,题干素材涉及生物知识,很好的考查了学生化学反应原理的掌握水平.


科目:高中化学 来源: 题型:选择题
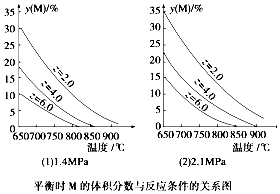
| A. | a+b<c+d | |
| B. | 同温同压时,增加z,平衡时Q的体积分数增加 | |
| C. | 同压同z时,升高温度,气体平均摩尔质量增加 | |
| D. | 同温同z时,增加压强,平衡时Q的物质的量浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
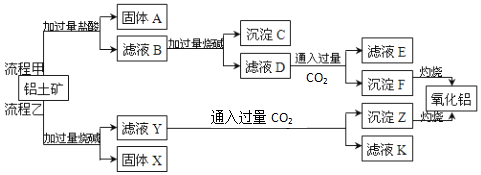
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:Na+、Fe2+、MnO4-、AlO2- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-12mol/L,的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | PH=0的溶液中:Al3+、Ag(NH3)2+、I-、SO42- | |
| D. | 加入Mg能放出H2的溶液中:Ca2+、NH4+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
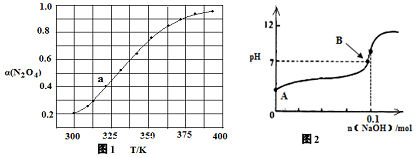
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制作印刷电路板:Fe3++Cu═Cu2++Fe2+ | |
| B. | 等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | Ca(OH)2溶液与足量Ca(HCO3)2溶液反应:Ca2++2HCO3-+2OH-═2CaCO3↓+2H2O+CO32- | |
| D. | 新制饱和氯水中加入石灰石可提高溶液中HClO浓度:CaCO3+2Cl2+H2O═Ca2++2Cl-+CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟利昂-12的结构式为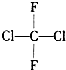 ,该分子是平面型分子 ,该分子是平面型分子 | |
| B. | 苯与液溴混合后撤入铁粉发生了加成反应 | |
| C. | 分子式为C4H9Cl的同分异构体共有4种 | |
| D. | 1mol苹果酸(HOOCCHOHCH2COOH)可与3molNaHCO3发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:P4(白磷,s)═4P(红磷,s),△H<0,则白磷比红磷稳定 | |
| B. | 由S (s)+O2(g)═SO2(g) (g)△H=-296.8 kJ•mol-1可知硫的标准燃烧热为296.8 kJ•mol-1 | |
| C. | OH-(aq)+H+(aq)═H2O(l)△H=-57.3 kJ•mol-1,故1 mol醋酸与1 mol NaOH完全反应,放出的热量为57.3 kJ•mol-1 | |
| D. | 甲醇燃料电池中,通入甲醇的一极为负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com