
【题目】下列叙述不正确的是
A.![]() 溶液加水稀释后,溶液中
溶液加水稀释后,溶液中![]()
![]() 的值减小
的值减小
B.中和滴定时,滴定管用所盛装的反应液润洗![]() 次
次
C.浓度均为![]() 的下列溶液,pH由大到小的排列顺序为:
的下列溶液,pH由大到小的排列顺序为:![]()
D.为确定HA是强酸还是弱酸,常温下可测![]() 溶液的pH:若
溶液的pH:若![]() ,则HA是弱酸;若
,则HA是弱酸;若![]() ,则HA是强酸
,则HA是强酸
【答案】C
【解析】
A.加水稀释醋酸,促进醋酸电离,但是醋酸电离增大程度小于溶液体积增大程度,所以溶液中![]() 减小,选项A正确;
减小,选项A正确;
B.中和滴定时,滴定管内所盛的反应液应该润洗![]() 次,否则导致溶液浓度降低,测定值偏大,选项B正确;
次,否则导致溶液浓度降低,测定值偏大,选项B正确;
C.NaOH溶液是强碱溶液![]() ;
;![]() 溶液中碳酸根离子水解,溶液呈碱性,
溶液中碳酸根离子水解,溶液呈碱性,![]() ,碱性小于氢氧化钠溶液,
,碱性小于氢氧化钠溶液,![]() 水解程度小于碳酸钠,所以碱性
水解程度小于碳酸钠,所以碱性![]() 大于
大于![]() ,
,![]() 和
和![]() 溶液由于水解显酸性,
溶液由于水解显酸性,![]() 中的c(NH4+)大于NH4Cl中的c(NH4+),所以
中的c(NH4+)大于NH4Cl中的c(NH4+),所以![]() 的酸性大于
的酸性大于![]() ,所以溶液的pH由大到小的排列顺序为:
,所以溶液的pH由大到小的排列顺序为:![]() ,选项C错误;
,选项C错误;
D.常温下可测![]() 溶液的pH:若
溶液的pH:若![]() ,说明溶液中
,说明溶液中![]() ,则HA部分电离,所以HA是弱酸;若
,则HA部分电离,所以HA是弱酸;若![]() ,说明溶液中
,说明溶液中![]() ,HA完全电离,则HA是强酸,选项D正确;
,HA完全电离,则HA是强酸,选项D正确;
答案选C。


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】(1)配平氧化还原反应方程式:____________
________![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]()
(2)称取6.0g含![]() 、
、![]() 和
和![]() 的试样,加水溶解,配成250ml溶液。量取两份此溶液各25.00ml,分别置于两个锥形瓶中。
的试样,加水溶解,配成250ml溶液。量取两份此溶液各25.00ml,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20.00ml时,溶液由无色变为浅红色。该溶液被中和的![]() 的总物质的量为____mol。
的总物质的量为____mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液。
A.![]() 溶液在滴定过程中作_____
溶液在滴定过程中作_____![]() 填“氧化剂”或“还原剂”
填“氧化剂”或“还原剂”![]() ,该滴定过程___
,该滴定过程___![]() 填“需要”或“不需要”
填“需要”或“不需要”![]() 另加指示剂。滴至16.00ml时反应完全,此时溶液颜色由____变为_____。
另加指示剂。滴至16.00ml时反应完全,此时溶液颜色由____变为_____。
B.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果____![]() 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响”![]() 。
。
C.若在达到滴定终点时俯视读数,则所得结果_____![]() 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响”![]() 。
。
③原试样中![]() 的质量分数为______,
的质量分数为______,![]() 的质量分数为_____。
的质量分数为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A.![]() 溶液加水稀释后,溶液中
溶液加水稀释后,溶液中![]()
![]() 的值减小
的值减小
B.中和滴定时,滴定管用所盛装的反应液润洗![]() 次
次
C.浓度均为![]() 的下列溶液,pH由大到小的排列顺序为:
的下列溶液,pH由大到小的排列顺序为:![]()
D.为确定HA是强酸还是弱酸,常温下可测![]() 溶液的pH:若
溶液的pH:若![]() ,则HA是弱酸;若
,则HA是弱酸;若![]() ,则HA是强酸
,则HA是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测量结果偏高的是
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡;②在配制烧碱溶液时,将称量后的NaOH固体溶于水,立即移入容量瓶,将洗涤烧杯的液体注入容量瓶后,加蒸馏水至刻度线;③中和滴定时,锥形瓶内有少量水;④酸式滴定管用蒸馏水洗后,未用标准液润洗;⑤读取滴定管终点读数时,仰视刻度线。
A.①②③B.③④⑤C.②④⑤D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铅蓄电池充电时,阳极质量增大
B. 0.1mol ·L-lCH3COONa溶液加热后,溶液的pH减小
C. 标准状况下,11.2L苯中含有的碳原子数为3×6.02×1023
D. 室温下,稀释0.1mol·L-1氨水,c(H+)·c(NH3·H2O)的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知前四周期A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态;D原子L电子层上有2对成对电子;E基态原子有6个未成对电子:
请填写下列空白:
(1)E元素在元素周期表的位置是______,E元素基态原子的价电子排布式为_____;
(2)C基态原子的价层电子的轨道表达式______;
(3)B2A4是重要的基本石油化工原料。1molB2A4分子中含_____molσ键;
(4)BD2电子式为_____,此分子键角为_______;
(5)BD32-中心原子孤电子对数为______,离子的立体构型为______;
(6)B、C、D三种元素的第一电离能由小到大的顺序为______(填元素符号),其原因为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.常温下,![]() 的碱性溶液中不可能存在
的碱性溶液中不可能存在![]() 分子
分子
B.常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
C.![]() 溶液加水稀释,溶液的pH和
溶液加水稀释,溶液的pH和![]() 的电离度均增大
的电离度均增大
D.将![]() 溶液滴入含酚酞的
溶液滴入含酚酞的![]() 溶液,红色褪去,说明
溶液,红色褪去,说明![]() 溶液显酸性
溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列表格中信息填写
有机物A | 有机物B | 有机物C | 有机物D |
1.该物质的产量是衡量一个国家石油化工水平的标志 2.比例模型: | 1.该物质为天然气的主要成分 2.比例模型: | 1.该物质由碳,氢,氧三种元素组成 2.75%的该物质的水溶液可做医用消毒剂 | 1.分子式为C2H4O2 2.该物质的水溶液显酸性,是家庭常用调味剂 |
(1)有机物A的结构简式为_________________,它与溴水反应的化学方程式为___________________。
(2)有机物B的空间构型为_______________________将有机物B与氧气分别通入如图装置的两极组成燃料电池,该电池的负极反应为____________________________正极反应为_____________________________。
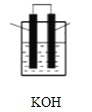
(3)有机物D在水溶液中的电离方程式为_______________________。 将pH=3的D溶液加水稀释10倍,所得溶液的pH_____4(填“大于”,“小于”),0.1molD与等量的NaOH溶液恰好完全反应的生成物显__________性(填“酸”或“碱”),该溶液中存在的电荷守恒关系式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S水溶液中存在电离平衡:H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-,若向H2S溶液中( )
H++S2-,若向H2S溶液中( )
A.加入硫酸,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,溶液酸性减弱
C.通入氯气,平衡向左移动,溶液酸性增强
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com