
【题目】下列热化学方程式书写正确的是( )
A.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH=+285.8kJ·mol-1
B.甲烷的燃烧热为△H=-890kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJmol-1
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJmol-1
2NH3(g) △H=-38.6kJmol-1
D.25℃、101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ·mol-1,则2H+(aq)+SO![]() (aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ΔH=-114.6kJ·mol-1
(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ΔH=-114.6kJ·mol-1
【答案】B
【解析】
A. 2gH2完全燃烧生成液态水,放出285.8kJ热量,即1molH2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式表示为:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8kJ·mol-1,A错误;
B. 甲烷的燃烧热为△H=890kJmol1,可知1molCH4(g)燃烧生成二氧化碳和液态水放出热量为890kJ,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=890kJmol1,B正确;
C. 合成氨为可逆反应,热化学方程式是为完全转化时的能量变化,将0.5molN2和1.5molH2置于密闭的容器中充分反应,生成NH3,放热19.3kJ,生成NH3的物质的量小于1mol,若1mol N2完全转化生成NH3,其热方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H<38.6kJmol1,C错误;
2NH3(g) △H<38.6kJmol1,C错误;
D. 中和热是指强酸强碱的稀溶液完全中和生成1mol水时所释放的能量,其△H=57.3kJmol1,生成BaSO4放热,由中和热及物质的量与热量成正比可知,![]()
![]() ,D错误;
,D错误;
答案为B。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
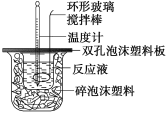
(1)烧杯间填满碎泡沫塑料的作用是_________;
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?_____(填“能”或“不能”),其原因是_________
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是_________;实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量_____(填“相等”或“不相等”),若实验操作均正确,则所求中和热________(填“相等”或“不相等”);
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol 水时,放出57.3 kJ的热量,则上述反应的热化学方程式为: _____________。
(5)倒入NaOH溶液的正确操作是 _________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(6)某同学利用实验数据计算出的中和热与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)____________。
a.实验装置保温、隔热效果差;
b.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度;
c.量取NaOH溶液的体积时仰视读数;
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能。下列有关叙述正确的是( )

A.E2表示反应X→C的活化能
B.X是反应A+B→C的催化剂
C.反应A+B→C的ΔH<0
D.加入催化剂可改变反应A+B→C的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5mol·L-1MgCl2溶液中c(Cl-)为___mol·L-1,从100mL该溶液中取出20mL再稀释至100mL,c(MgCl2)为__mol·L-1。
(2)将SO2通入氯化钡溶液中无现象;若将SO2通入硝酸钡溶液中有白色沉淀产生,其化学反应方程式如下(未配平):SO2+Ba(NO3)2+H2O→BaSO4↓+HNO3+NO↑。
①配平上述化学反应方程式并用双线桥表示电子转移的方向和数目___。
②该反应中,__元素发生氧化反应,氧化剂是__(写化学式)。氧化产物与还原产物的物质的量之比为___。
③当反应消耗19.2gSO2时,反应中转移电子__mol,在标准状况下,生成NO的体积为__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的有( )
①化学反应除了生成新物质外,还伴随着能量的变化
②放热反应不需要加热就能发生
③需要加热才能发生的反应都是吸热反应
④化学反应放热还是吸热决定于生成物具有的总能量和反应物具有的总能量的大小
⑤热化学方程式应注明反应时的温度与压强,如没注明则表示标准状况时的反应
⑥等量的氢气和氧气分别完全燃烧生成气态水和液态水,前者放出的热量多
⑦H2(g)+I2(g)![]() 2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1molH2和1molI2(g)反应生成2molHI时放出QkJ的热量
2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1molH2和1molI2(g)反应生成2molHI时放出QkJ的热量
⑧同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件下和点燃条件下的ΔH相同
A.2项B.3项C.4项D.5项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示实验装置,回答下列问题。

(1)写出下列仪器的名称:①___,④___。
(2)仪器①~④中,使用时必须检查是否漏水的是___(填序号)。
(3)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器是___,②的进水口是__(填“f”或“g”)。
(4)配制溶液时,下列操作会导致所配溶液的浓度偏低的是__(填标号)。
a.洗涤烧杯和玻璃棒的溶液未转移入容量瓶中
b.定容时,眼睛俯视使溶液凹面最低点与容量瓶刻度线相切
c.容量瓶中原残留有少量蒸馏水
d.定容后加水过量,又从容量瓶中取出部分溶液,使液面降至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c(NO2)与温度的关系如图所示。下列说法正确的是( )
2NO2(g)+S(s)。改变容器I的反应温度,平衡时c(NO2)与温度的关系如图所示。下列说法正确的是( )


A.该反应的ΔH>0
B.T1时,该反应的平衡常数为![]()
C.容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比大于1:2
D.若T2<T1,达到平衡时,容器Ⅲ中NO的体积分数大于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程可以达到实验目的的是( )
| 实验目的 | 实验过程 |
A. | 制取并纯化氨气 | 向浓氨水中加入生石灰,将产生的气体通过盛有 |
B. | 探究 | 向 |
C. | 比较 | 向 |
D. | 探究浓度对化学反应速率的影响 | 其他条件一定,向2支均盛有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D为由短周期元素组成的四种物质,它们有如下所示转化关系,且D为强电解质(其他相关物质可能省略)。
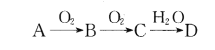
下列说法不正确的是
A. 若A为非金属单质,则它与Mg反应的产物中阴、阳离子个数比可能为2:3
B. 若A为非金属单质,则其组成元素在周期表中的位置可能处于第二周期第IVA族
C. 若A是共价化合物,则A和D有可能发生氧化还原反应
D. 若A是金属或非金属单质,则常温下0. 1 mol/L的D溶液中由水电离出的c(H+)可能为10-13mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com