
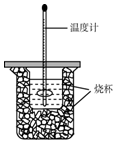
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出热量可计算中和热.回答下列问题:分析 (1)根据量热计的构造来判断该装置的缺少仪器;根据金属棒是热的良导体,易传热,而且能与盐酸反应;
(2)中和热测定实验成败的关键是保温工作;
(3)不盖硬纸板,会有一部分热量散失;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(5)根据弱电解质电离吸热分析.
解答 解:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;铁质搅拌棒的导热性好,易传热,散发热量,所得中和热的测定值比理论值偏低,而且铁会与盐酸反应;
故答案为:环形玻璃搅拌棒;铁的导热系数大,容易散热;铁会与盐酸反应;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,
故答案为:减少实验过程中的热量损失;
(3)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,
故答案为:偏小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,如果用60ml0.50mol/L酸盐与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60ml0.50mol/L酸盐与50mL0.55mol/LNaOH溶液进行反应,测得中和热数值相等;
故答案为:不相等;相等;中和热是指稀强酸与稀强碱发生中和反应生成1 mol H2O放出的热量,与酸碱的用量无关;
(5)一水合氨为弱碱,电离过程为吸热过程,用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值偏小;
故答案为:偏小.
点评 本题主要考查了中和热的测定,可以根据所学知识进行回答,注意保温工作是实验成功的关键,题目难度不大.


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:选择题
| A. | 672 mL | B. | 168 mL | C. | 504 mL | D. | 224 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
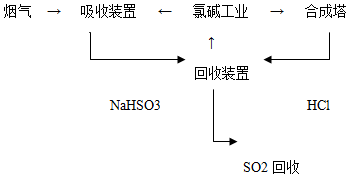
| 分析推测 | 实验步骤及现象 |
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2?Fe(SO2)63+(反应b) | I、制备Fe(OH)3胶体并检验 II、分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用农作物秸秆制取乙醇 | |
| B. | 回收地沟油,制备生物柴油 | |
| C. | 焚烧废旧塑料,防止白色污染 | |
| D. | 开发利用各种新能源,减少对化石燃料的依赖 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| B. | 石油是混合物,其分馏产品汽油为纯净物 | |
| C. | 煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气 | |
| D. | 石油分馏可获得乙酸、苯及其衍生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
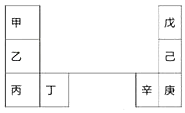 甲~辛等元素在周期表中的相对位置如表.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质.下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如表.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质.下列判断正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 原子半径:辛>己>戊 | |
| C. | 丙和庚的原子核外电子数相差11 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com