下列说法正确的是( )
A.铁遇冷浓硝酸、浓硫酸表面形成致密氧化膜(钝化),可保护内部不被腐蚀
B.钢铁发生电化腐蚀时,负极反应是Fe-3e-=Fe3+
C.白铁(镀锌铁)在镀层破损后,首先被腐蚀的是铁
D.将镁片跟铝片用导线连接后平行插入一定浓度的NaOH溶液中,镁做负极,铝上有气泡逸出
【答案】分析:A.常温下,铁、铝和浓硝酸、浓硫酸发生钝化现象;
B.钢铁发生电化学腐蚀时,负极上铁失电子生成亚铁离子;
C.锌、铁和电解质溶液构成原电池时,作负极的金属易被腐蚀;
D.铝、镁和氢氧化钠溶液构成原电池时,铝易失电子而作负极,镁作正极.
解答:解:A.常温下,铁、铝和浓硝酸、浓硫酸发生钝化现象,使铁表面生成一层致密的氧化物薄膜而阻止进一步反应,所以可保护内部不被腐蚀,故A正确;
B.钢铁发生电化学腐蚀时,负极上铁失电子生成亚铁离子,电极反应式为:Fe-2e-=Fe2+,故B错误;
C.锌、铁和电解质溶液构成原电池时,锌作负极,铁作正极,则作负极的锌易被腐蚀,故C错误;
D.铝、镁和氢氧化钠溶液构成原电池时,铝易失电子而作负极,镁作正极,镁电极上氢离子得电子生成氢气,故D错误,
故选A.
点评:本题考查了金属的腐蚀与防护,明确金属性质是解本题关键,易错选项是D,注意不能根据金属的活泼性确定原电池的正负极,要根据得失电子判断原电池的正负极,为易错点.




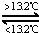 Sn(s,白)△H3=+2.1kJ?mol-1,
Sn(s,白)△H3=+2.1kJ?mol-1,