
【题目】H2S以及COS(羰基硫)是化学工作者重要的研究对象。请回答下列问题:
(1)COS的分子结构与CO2相似,COS的电子式为_________。
(2)已知:①COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=-17KJ/mol
H2S(g)+CO(g) ΔH1=-17KJ/mol
②COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-35kJ/mol
H2S(g)+CO2(g) ΔH2=-35kJ/mol
③CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH3
H2(g)+CO2(g) ΔH3
则ΔH3=__________
(3)已知常温下,Ksp(CuS)=1.0×10-39,Ksp(PbS)=9.0×10-29。向含有浓度均为0.01mol/L的Cu2+、Pb2+废水中缓慢通入H2S,首先生成的沉淀的化学式是_______;当生成两种沉淀时,c(Pb2+)/c(Cu2+)=__________.
(4)某温度T下,在密闭容器中充入5molH2O(g)和5molCOS(g),测得混合气体中H2S体积分数(Φ)与时间(t)的关系如图所示。
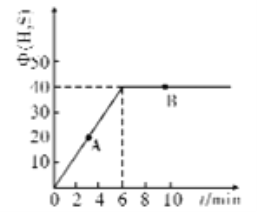
①A点COS的正反应速率_______(填“大于”“小于”或“等于”)B点COS的逆反应速率。
②在该条件下,COS的平衡转化率为________
③在该温度下,该反应的平衡常数K=__________
④在B点对应的体系中,改变下列条件,能使COS转化率增大的是______
A.再通入H2O(g) B.加压 C.降温 D.加入催化剂
【答案】 ![]() -18kJ/mol CuS 9.0×107 大于 80% 16.0 AC
-18kJ/mol CuS 9.0×107 大于 80% 16.0 AC
【解析】(1)COS的分子结构与CO2相似,所以COS的电子式为![]() 。
。
(2)①COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=-17KJ/mol
H2S(g)+CO(g) ΔH1=-17KJ/mol
②COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-35kJ/mol
H2S(g)+CO2(g) ΔH2=-35kJ/mol
③CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH3
H2(g)+CO2(g) ΔH3
根据已知由 ②-①=③所以ΔH3=ΔH2-ΔH1=-35kJ/mol-(-17KJ/mol)=-18 kJ/mol
(3)已知常温下,Ksp(CuS)=1.0×10-39,所以c(Cu 2-).c(S 2-)=Ksp(CuS)=1.0×10-39 所以c(S 2-) =(1.0×10-39)/ 0.01mol/L=1.0×10-37mol/L;c(Pb2+).c(S 2-)=Ksp(PbS)=9.0×10-29,c(S 2-)=(9.0×10-29)/ 0.01mol/L=9.0×10-27 mol/L,所以首先生成的沉淀的化学式CuS。在同一溶液中,当同时生成两种沉淀时,c(Pb2+)/c(Cu2+)=(9.0×10-29)mol/L /(1.0×10-37)mol/L== 9.0×107
(4)①A点COS的反应没有达到平衡,所以反应仍然向正反应方向进行,反应物的浓度大于达到平衡时B点COS的浓度,B点COS的反应达到平衡了,正反应速率等于逆反应的速率。所以A点COS的正反应速率大于B点COS的逆反应速率。
②在该条件下, 由COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-35kJ/mol
H2S(g)+CO2(g) ΔH2=-35kJ/mol
起始量(mol) 5 5 0 0
变化量(mol) X X X X
平衡量(mol) 5-X 5-X X X
由图知平衡时H2S(g)的体积分数为40![]() ,所以X/( 5-X +5-X +X +X)
,所以X/( 5-X +5-X +X +X) ![]() 100
100![]() =40
=40![]() ,X=4 mol
,X=4 mol
所以COS的平衡转化率=4/5![]() 100
100![]() =80%.答案:80%。
=80%.答案:80%。
③在该温度下,该反应的平衡常数K=[c(H2S).c(CO2)]/[c(COS).c(H2O)]=4![]() 4/1
4/1![]() 1=16.0;答案:16.0
1=16.0;答案:16.0
④A.再通入H2O(g)使平衡正反应方向进行,COS转化率增大,符合题意,故A正确;B. COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-35kJ/mol,是反应前后气体体积数相等的反应,加压,化学反应平衡不移动,反应物的转化率不会增加,故B错误;C因为此反应是放热反应,降温时,化学平衡向正反应方向移动,COS转化率增大,故C符合题意;D.催化剂只改变化学反应速率,不会影响化学平衡移动,所以不会使COS转化率增大,故D不符合题意;答案:AC。
H2S(g)+CO2(g) ΔH2=-35kJ/mol,是反应前后气体体积数相等的反应,加压,化学反应平衡不移动,反应物的转化率不会增加,故B错误;C因为此反应是放热反应,降温时,化学平衡向正反应方向移动,COS转化率增大,故C符合题意;D.催化剂只改变化学反应速率,不会影响化学平衡移动,所以不会使COS转化率增大,故D不符合题意;答案:AC。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】合成H的两条途径如图:


回到下列问题:
(1)关于H说法正确的是_________(填标号)。
a.能使溴水褪色 b.1mol该物质最多能与3mol NaOH反应
c.属于芳香烃类物质 d.分子内最多有9个碳原子共平面
(2)C生成D的反应类型为____________,G的名称为____________。
(3)写出D生成E的化学方程式____________________________________。
(4)已知物质M与D互为同分异构体,M的水溶液呈酸性,在一定条件下2molM能生成1mol分子中含六元环结构的有机物,则M在铜的催化下与氧气反应的化学方程式为____________________________________________________________。
(5)满足下列所有条件的F(结构简式见已知)的同分异构体的数目有________种。
a.能发生银镜反应 b.苯环上有两个取代基
写出上述异构体中能使FeCl3溶液显紫色,核磁共振氢谱有五组峰且面积比为1:2:2:2:1的结构简式________________________。
(6)结合已有知识和信息并参照上述合成路线,以丙醇为起始原料(无机试剂任选),设计制备 的合成路线。_______________
的合成路线。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】托特罗定(G)是毒蕈碱受体拮抗剂,其一种合成路线流程图如下:

(1)C中含氧官能团名称为__________和__________。
(2)D生成E的反应类型为__________。
(3)化合物X的分子式为C9H8O2,写出X的结构简式:__________。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:__________。
能发生水解反应,两种水解产物均能与FeCl3溶液发生显色反应且分子中均只有4种不同化学环境的氢。
(5)已知:R1-CHO![]()
![]() (R1、R2代表烃基或H)
(R1、R2代表烃基或H)
请写出以![]() 、CH3CHO和(CH3)2SO4为原料制备
、CH3CHO和(CH3)2SO4为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)不溶于乙醇,20℃、80℃时溶解度依次为70.1、231g/100gH2O。可用作纸浆漂白时的脱氯剂等。用工业硫化钠(主要成分Na2S,含少量Na2SO4、Na2CO3等)及纯碱等为原料制备Na2S2O3·5H2O的实验流程如下:

(1)用Na2S2O3脱除纸浆中多余Cl2的离子反应方程式为__________。
(2)“净化”时加入的试剂X可能是__________ (填化学式)。
(3)“趁热过滤”时,用双层滤纸过滤的原因是__________。
(4)制备Na2S2O3的实验装置如下图所示:

①装置连接好并装入药品后,检验装置是否漏气的方法是__________。
②实验过程中打开螺旋夹并调节螺旋夹至适当的位置,一方面使反应产生的SO2气体较均匀地通入Na2S-Na2CO3溶液中,另一方面的作用是__________。
③请设计由三口烧瓶中的反应液制备Na2S2O3·5H2O的实验方案:拆解装置,__________,将固体放在40℃烘箱中干燥40min,制得Na2S2O3·5H2O(实验中须使用的试剂有:2mol·L-1NaOH溶液、95%乙醇)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列组合属于同素异形体的是
A. 3517Cl与3717Cl B. 金刚石与C60
C. CH3CH2CH2CH3和(CH3)2CHCH3 D. CH3CH3与CH3CH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积均为10 mL、物质的量浓度相同的两份NaOH 溶液中分别通入一定量的CO2,得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1mol/L的盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积的关系如图所示。则下列叙述中不正确的是

A. 原NaOH溶液的物质的量浓度为0.5 mol/L
B. 当0盐酸)<10 mL时,甲溶液中发生反应的离子方程式为H++CO32-=HCO3-
C. 乙溶液中含有的溶质是Na2CO3、NaOH
D. 向乙溶液中滴加过量盐酸后产生CO2体积的最大值为224 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯毒素是广谱抗菌素,主要用于治疗伤寒杆菌、痢疾杆菌、脑膜炎球菌、肺炎球菌的的感染。其中一种合成路线如下:
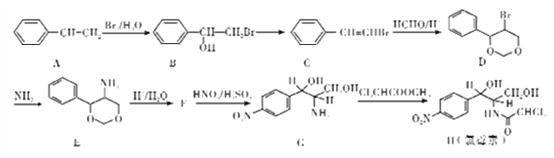
已知: 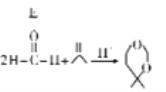
(1)A![]() B,G
B,G![]() H反应类型分别是:____、____。
H反应类型分别是:____、____。
(2)写出B![]() C的化学方程式(注明反应条件)________
C的化学方程式(注明反应条件)________
(3)写出F的结构简式_______
(4)写出H(氯霉素)分子中所们含氧官能团的名称____。1mol氯霉素最多消耗_____molNaOH。
(5)符合下列条件的E的同分异构体共有____________种。
①苯环上含有两个对位取代基,一个是氨基
②能水解
③能发生银镜反应
写出其中一种的结构简式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备1,2一二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略)。
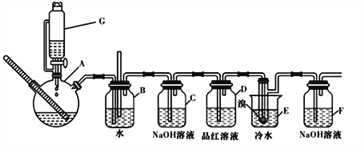
有关数据列表如下:

请按要求回答下列问题:
已知:CH3CH2OH![]() CH2=CH2 ↑+H2O
CH2=CH2 ↑+H2O
(1)G中药品为1:3无水乙醇和浓硫酸混合液,用来制备乙烯,装置G的名称为_____
(2)装置B中长直导管的作用是_____________
(3)反应过程中应用冷水冷却装置E中大试管,但又不能过度冷却(如用冰水),其原因是_____
(4)某学生发现反应结束时,G中试剂消耗量大大超过理论值(装置不漏气),其原因是_____(任写出一种可能的原因)
(5)有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,其原因是______
(6)若消耗无水乙醇的体积为100 mL,制得1,2一二溴乙烷的体积为40 mL,则该反应的产率为___(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一容积固定的密闭反应器,中间有一个可自由移动的导热的隔板将容器分成甲、乙两部分,分别发生下列两个可逆反应:

甲:a(g)+b(g)![]() 2c(g) ΔH1<0、乙: x(g)+3y(g)
2c(g) ΔH1<0、乙: x(g)+3y(g)![]() 2z(g) ΔH2>0
2z(g) ΔH2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是
A. 在反应器恒温下,向乙中通入z气体,c的物质的量浓度增大
B. 在反应器恒温下,向甲中通入惰性气体,乙中x、y的转化率增大
C. 在反应器绝热下,向乙中通入z气体,反应器中温度升高
D. 在反应器绝热下,向甲中通入惰性气体,c的物质的量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com