
【题目】某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)22SO4的工艺流程:
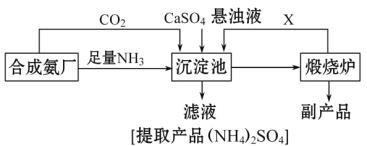
请回答以下问题:
(1)工业合成氨反应的条件是_____________________。沉淀池中发生的主要反应方程式是________________________。该反应能够发生的原因是__________________________。
(2)提纯滤液以获得(NH4)2SO4晶体,必要的操作步骤是:__________(填序号)。
A.萃取 B.蒸发浓缩 C.冷却结晶 D.蒸馏
(3)上述生产流程中,有关NH3的作用及说明正确的是:__________(填序号)。
A.提供制备所需的氮元素
B.增大CO32-的浓度促进反应发生
C.作反应的催化剂
D.生产1 mol (NH4)2SO4,至少消耗2 mol NH3
(4)该生产过程中的副产品是_______________,从绿色化学和资源综合利用的角度说明上述流程的主要优点是______________.缺点是_____________。
【答案】高温、高压、催化剂 2NH3+CO2+ CaSO4+H2O=CaCO3+(NH4)2SO4 碳酸钙的溶解度小于硫酸钙的溶解度 BC ABD 氧化钙 产生的CO2循环使用,得到的产品和副产品都是有用的物质,无废物产生 硫酸钙的溶解度较小,此生产过程的反应速率较慢,原料的转化率较低,故生产效率比较低
【解析】
(1)合成氨反应条件需要高温、高压、催化剂;根据流程可以判断出NH3、CO2和 CaSO4反应的产物;利用沉淀溶解平衡原理分析反应发生的原因;
(2)获得晶体,应先浓缩溶液,再进行冷却结晶,从而得到晶体;
(3)根据工艺流程图可以判断NH3的作用;
(4)在煅烧炉中煅烧CaCO3可得到氧化钙和二氧化碳,据此判断;优点从流程中可以找到二氧化碳的循环利用,得到的产品和副产品都是有用的物质角度分析;缺点从硫酸钙溶解度较小,浓度小,反应速率慢,转化率低角度进行分析。
(1)工业合成氨反应的条件是高温、高压、催化剂;将NH3和CO2通入沉淀池中并加入CaSO4,生成(NH4)2SO4和CaCO3,发生反应为:2NH3+CO2+ CaSO4+H2O=CaCO3+(NH4)2SO4;该反应能够发生的原因是碳酸钙的溶解度小于硫酸钙的溶解度,反应向溶解度较小的方向进行;综上所述,本题答案是:高温高压催化剂,2NH3+CO2+ CaSO4+H2O=CaCO3↓+(NH4)2SO4;碳酸钙的溶解度小于硫酸钙的溶解度。
(2)从溶液中获取晶体应采取蒸发浓缩、冷却结晶等操作,所以必须操作步骤是BC;因此,本题正确答案是:BC。
(3)A.氨气被转化为硫酸铵晶体,提供了所需要的氮元素,故A正确;
B.氨气可以与CO2反应,促进CO2转化为CO32-,而增大CO32-的浓度,故B正确;
C.氨气参与反应,其物质的量减少,不做催化剂,故C错误;
D.根据化学方程式可以知道,生产1mol(NH4)2SO4,至少消耗2molNH3,故D正确;
综上所述,本题选ABD。
(4)反应发生后,生成碳酸钙和硫酸铵;分离出碳酸钙后,再进行高温煅烧,碳酸钙分解为氧化钙和二氧化碳,所以该生产过程中的副产品是氧化钙;该流程中,产生的CO2循环使用,得到的产品和副产品都是有用的物质,无废物产生;缺点是由于硫酸钙的溶解度较小,此生产过程的反应速率较慢,原料的转化率较低,故生产效率比较低。综上所述,本题答案是:氧化钙;产生的CO2循环使用,得到的产品和副产品都是有用的物质,无废物产生;硫酸钙的溶解度较小,此生产过程的反应速率较慢,原料的转化率较低,故生产效率比较低。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。2R-C≡C-H![]() R-C≡C-C≡C-R+H2, 该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
R-C≡C-C≡C-R+H2, 该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为________,D的化学名称为________。
(2)①和③的反应类型分别为________、________。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气__ mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为__________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为__________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3∶1,写出其中3种的结构简式_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊在元素周期表中的相对位置如图所示。下列说法正确的是
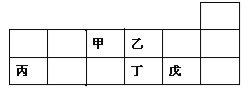
A. 原子半径的大小顺序为:甲>乙>丙>戊
B. 氢化物的稳定性:乙>丁;氢化物的沸点:丁>乙
C. 元素甲与元素丙的最高正化合价之和的数值等于8
D. 元素戊的氧化物对应的水化物的酸性一定比丁的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为0.2mol·L-1,0.2 mol·L-1,0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( )
2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为0.2mol·L-1,0.2 mol·L-1,0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( )
A. c(SO3)=0.4 mol·L-1B. c(SO2)=c(SO3)=0.15 mol·L-1
C. c(O2)=0.1 mol·L-1D. c(SO2)+c(SO3)=0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V L浓度为0.5 mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )。
A. 通入标准状况下的HCl气体11.2V L
B. 加入10 mol·L-1的盐酸0.1V L,再稀释至1.5V L
C. 将溶液加热浓缩到0.5V L
D. 加入V L 1.5 mol·L-1的盐酸混合均匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是
A. 1mol NH3所含有的原子数为NA
B. 常温常压下,22.4L氧气所含的原子数为2NA
C. 常温常压下,48g O3所含的氧原子数为3NA
D. 1 L 0.1mol/LNaCl溶液中所含的Na+为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述不正确的是:
A. 2.7 g 金属铝分别与足量的NaOH溶液和盐酸反应转移的电子数目均为0.3NA
B. 标准状况下,2.24 L Cl2与过量NaOH溶液反应,转移的电子总数为0.1 NA
C. 1L 1 molL-1 Na2CO3溶液中阴离子数小于NA
D. 2.3 g金属钠完全反应生成Na2O与Na2O2的混合物中阴离子数为0.05 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为CH2===CH2(g)+H2O(g) ![]() CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是:
CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是:
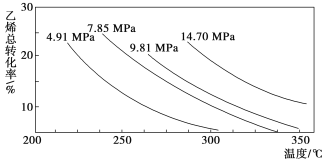
A. 合成乙醇的反应一定为吸热反应
B. 目前工业上采用250~300 ℃,主要是因为在此温度下乙烯的转化率最大
C. 目前工业上采用加压条件(7 MPa左右),目的是提高乙醇的产率和加快反应速率
D. 相同催化剂下,在300 ℃ 14.70 MPa乙醇产率反而比300 ℃ 7.85 MPa低得多,是因为加压平衡向逆反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com