
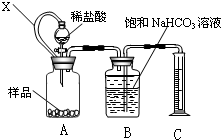
 某种胃药中抗酸剂为CaCO3.甲、乙两同学为测定其中CaCO3含量,分别设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应).请回答下列有关问题:
某种胃药中抗酸剂为CaCO3.甲、乙两同学为测定其中CaCO3含量,分别设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应).请回答下列有关问题: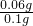 ×100%=60%,故答案为:60%;
×100%=60%,故答案为:60%;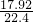 ×10-3mol=0.0008mol,10mL0.100mol/L NaOH溶液中含有氢氧根离子的物质的量是0.01L×0.100mol/L=0.001mol,
×10-3mol=0.0008mol,10mL0.100mol/L NaOH溶液中含有氢氧根离子的物质的量是0.01L×0.100mol/L=0.001mol,

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
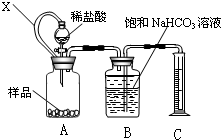 某种胃药中抗酸剂为CaCO3.甲、乙两同学为测定其中CaCO3含量,分别设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应).请回答下列有关问题:
某种胃药中抗酸剂为CaCO3.甲、乙两同学为测定其中CaCO3含量,分别设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应).请回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2009-2010学年江苏省扬州市高二(上)期末化学试卷(必修)(解析版) 题型:解答题
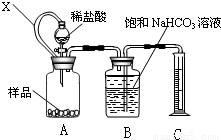
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省盐城中学高二(上)期中化学试卷(必修)(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com