
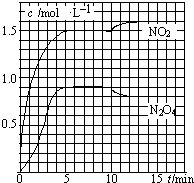
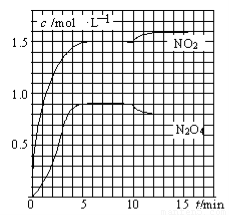
 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:| A、前5min反应的平均速率v(N2O4)=0.18mol?(L?min)-1 | B、T1℃时反应②的化学平衡常数K=0.6 | C、反应①、②均为吸热反应 | D、若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% |
| △c |
| △t |
| c(N2O4) |
| c2(NO2) |
| 变化量 |
| 初始量 |
| △c |
| △t |
| 0.9mol/L |
| 5min |
| c(N2O4) |
| c2(NO2) |
| 0.9 |
| 1.52 |
| (1.0+x)2 |
| 1.8-2x |


科目:高中化学 来源:2012届江西省红色六校高三第一次联考化学试卷 题型:填空题
(12分)汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g) + O2(g)  2NO(g) △H > 0已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H > 0已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率 。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志 。
| A.消耗1molN2同时生成1molO2 | B.混合气体密度不变 |
| C.混合气体平均相对分子质量不变 | D.2V(N2)正=V(NO)逆 |

查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省南通市高三第二次调研化学试卷(解析版) 题型:选择题
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
①2NO(g)+O2 (g) 2NO2(g)
2NO2(g)
②2NO2(g) N2O4(g)
N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃。下列说法正确的是
A.前5min反应的平均速率v(N2O4)=0.18mol·(L·min)-1
B.T1℃时反应②的化学平衡常数K=0.6
C.反应①、②均为吸热反应
D.若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10%
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省红色六校高三第一次联考化学试卷 题型:填空题
(12分)汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g) + O2(g)  2NO(g) △H > 0已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H > 0已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率 。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志 。
A.消耗1molN2同时生成1molO2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2V(N2)正=V(NO)逆
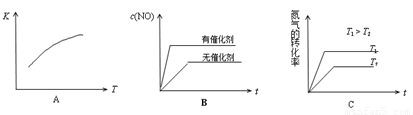
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 (填字母序号)。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数 。(填“变大、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应 (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g) + O2(g) 2NO(g) △H > 0已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率 。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志 。
A.消耗1molN2同时生成1molO2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2V(N2)正=V(NO)逆
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 (填字母序号)。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数 。(填“变大、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应 (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com