
 已知CO和CO2混合气体的质量为14.4g,在标准状况下的体积为8.96L,试回答下列问题:
已知CO和CO2混合气体的质量为14.4g,在标准状况下的体积为8.96L,试回答下列问题:分析 (1)标况下混合气体的体积为8.96L,其物质的量为:$\frac{8.96L}{22.4L/mol}$=0.4mol,根据M=$\frac{m}{n}$计算出平均摩尔质量;
(2)设出一氧化碳、二氧化碳的物质的量,根据气体的总质量和总物质的量列方程式计算;
(3)将混合气体依次通过如图装置,则CO2会被NaOH溶液吸收,剩余CO,被浓硫酸干燥后,则在气球中收集到的是干燥纯净的CO气体.
①一种物质的摩尔质量在数值上等于该物质的相对分子质量;
②气球中的气体为CO,根据体积V=nVm来计算.
解答 解:(1)混合气体的体积为8.96L,则物质的量为其物质的量为:$\frac{8.96L}{22.4L/mol}$=0.4mol,
混合气体的平均摩尔质量为:$\frac{14.4g}{0.4mol}$=36g/mol,
故答案为:36g/mol;
(2)设混合气体中CO的物质的量为xmol,CO2的物质的量为ymol,则根据混合物的质量为14.4g可得:28x+44y=14.4 ①;
根据气体的物质的量为0.4mol可得:x+y=0.4 ②
解①②得:x=0.2mol、y=0.2mol.
由于CO和CO2中均含1个碳原子,故0.2molCO和0.2molCO2中共含0.4molC原子即0.4NA个,故答案为:0.4NA;
(3)将混合气体依次通过如图装置,则CO2会被NaOH溶液吸收,剩余CO,被浓硫酸干燥后,则在气球中收集到的是干燥纯净的CO气体.
①气球中收集到的气体为CO,而一种物质的摩尔质量在数值上等于该物质的相对分子质量,故收集到气体的摩尔质量为28g/mol,故答案为:28g/mol;
②气球中的气体为CO,其体积V=nVm=0.2mol×22.4L/mol=4.48L,故答案为:4.48.
点评 本题考查了有关混合物反应的计算,题目难度中等,为高频考点,试题侧重于学生的分析能力和计算能力的考查,注意质量守恒定律在化学计算中的应用方法.


科目:高中化学 来源: 题型:选择题
| A. | 等于ω | B. | 大于ω,小于2ω | C. | 小于ω | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 )脱氢生成苯是放热反应,反应约为23.4kJ/mol,此事实能说明( )
)脱氢生成苯是放热反应,反应约为23.4kJ/mol,此事实能说明( )| A. | 1,3-环己二烯加氢是吸热反应 | |
| B. | 1,3-环己二烯的碳架变为苯环后,并不是简单的形成一个新的双键,而是具有了一个特殊稳定结构 | |
| C. | 1,3-环己二烯不及苯稳定 | |
| D. | 1,3-环己二烯加氢生成环己烷是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:氧化过程中温度需控制在55~60℃,发生的主要反应为C6H12O6+12HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3H2C2O4+9NO2↑+3NO↑+9H2O.
已知:氧化过程中温度需控制在55~60℃,发生的主要反应为C6H12O6+12HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3H2C2O4+9NO2↑+3NO↑+9H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6mol酒精 | B. | 标准状况下4.48L SO2 | ||
| C. | 0.36g H2O | D. | 含NA个氢原子的甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; (R1、R2代表烃基或氩原子)
(R1、R2代表烃基或氩原子)
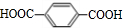 .
. +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;反应⑦的化学方程式为
+2H2O;反应⑦的化学方程式为 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com