
 正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如下:
正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如下: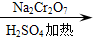 CH3CH2CH2CHO
CH3CH2CH2CHO| 沸点/℃ | 密度/(g?cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
| 2.16g×74 |
| 4g×72 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 温度(℃) | 300 | 400 | 500 |
| K② | 3.1×1015 | 1.66×1014 | 5.3×1013 |
| K③ | 4.0×1020 | 3.6×1018 | 5.7×1017 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
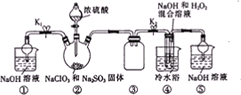 已知亚铝酸钠(NaClO2)为白色粉末,易溶于水,NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2
已知亚铝酸钠(NaClO2)为白色粉末,易溶于水,NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2查看答案和解析>>
科目:高中化学 来源: 题型:
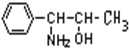
| A、一定条件下,可以发生消去反应 |
| B、一定条件下与Br2可以发生苯环上的取代反应 |
| C、具有弱碱性,可与强酸反应生成盐 |
| D、具有弱酸性,可与强碱反应生成盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
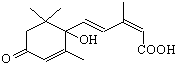 国庆期间对天安门广场大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )
国庆期间对天安门广场大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )| A、其分子式为C15H18O4 |
| B、1mol该物质与NaOH溶液反应,最多可消耗2mol NaOH |
| C、既能发生加成反应,又能发生取代反应和消去反应 |
| D、既能与FeCl3溶液发生显色反应,又能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、480mL容量瓶,称取7.68g硫酸铜,加入500mL水 |
| B、500mL容量瓶,称取12.0g胆矾配成500mL溶液 |
| C、480mL容量瓶,称取8.0g硫酸铜,加入500mL水 |
| D、500mL容量瓶,称取12.5g胆矾配成500mL溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com