
【题目】某无色溶液100mL,其中可能含Fe3+、Al3+、Na+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示。
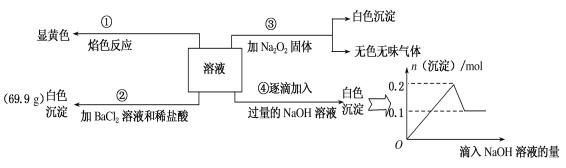
请回答下列问题:
(1)焰色反应是___(填“物理”或“化学”)变化;实验③中产生的无色无味气体是___(填化学式)。
(2)原溶液中一定存在的离子有___,一定不存在的离子有____。
(3)若溶液中K+物质的量为0.04mol,则c(Na+)=___mol/L。
(4)将一定量Fe2O3和Al2O3混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
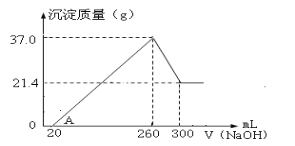
①混合物中含Fe2O3的质量为___g;
②所用硫酸溶液物质的量浓度为___mol/L。
【答案】物理 O2 Na+、Mg2+、Al3+、SO42- Fe3+、Cu2+、CO32-、NH4+ 0.6mol/L 16g 6.5mol/L
【解析】
溶液呈无色,则一定不含有色离子:Fe3+、Cu2+;
①溶液焰色反应呈黄色,说明溶液中含有Na+离子;
②加入氯化钡和盐酸后生成白色沉淀,由于溶液中没有Ag+离子,则生成沉淀为BaSO4,溶液中含有SO42-离子;
③加入Na2O2.与水反应生成NaOH,生成白色沉淀,说明有Mg2+,判断一定无CO32-,生成无色无味气体,为O2,说明没有NH4+;
④逐滴加入过量NaOH溶液有白色沉淀,图象分析可知,实验中生成白色沉淀的量与加入NaOH的量的先增大后减小,则说明溶液中含有Al3+离子;
综上所述可知:溶液中一定含有Na+、Mg2+、Al3+、SO42-,一定没有Fe3+、Cu2+、CO32-、NH4+,不能判断溶液中是否含有K+。
(1)焰色反应是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特征的颜色的反应,没有生成新物质,是物理变化;
实验③中Na2O2与溶液中的水发生反应:2Na2O2+2H2O=4NaOH+O2↑,产生的无色无味的气体是O2;
(2)根据上述分析,原溶液中一定含有Na+、Mg2+、Al3+、SO42-,一定没有Fe3+、Cu2+、CO32-、NH4+,不能判断溶液中是否含有K+;
(3)实验②中产生的BaSO4白色沉淀的物质的量为n(BaSO4)=69.9g÷233g·mol-1=0.3mol,依据图形变化可知,剩余的固体为Mg(OH)2,其物质的量为0.1mol,则Mg2+物质的量为0.1mol;溶解的固体为Al(OH)3,其物质的量为0.1mol,则Al3+物质的量为0.1mol,由于溶液体积为100ml,若溶液中K+物质的量为0.04mol,依据电荷守恒计算c(K+)+c(Na+)+3c(Al3+)+2c(Mg2+)=2c(SO42-),c(Na+)=2×3mol·L-1-0.4mol·L-1-3×1mol·L-1-2×1mol·L-1=0.6mol·L-1;
(4)Fe2O3和Al2O3,与稀硫酸反应生成Fe3+、Al3+,加入NaOH溶液,刚开始没有沉淀生成,说明溶液中还有H+,随后Fe3+和Al3+,与碱生成Fe(OH)3、Al(OH)3,260mL时,H+、Fe3+、Al3+均完全反应,沉淀有Fe(OH)3和Al(OH)3,溶液中只有Na2SO4,再滴加NaOH,Al(OH)3溶解。
①260mL时,H+、Fe3+、Al3+均完全反应,沉淀有Fe(OH)3和Al(OH)3,根据图示剩余的Fe(OH)3的质量为21.4g。Fe2O3+6H+=2Fe3++3H2O,Fe3++3OH-=Fe(OH)3↓,可得关系式Fe2O3~2Fe(OH)3,Fe(OH)3的质量为21.4g,其物质的量![]() ,则Fe2O3的物质的量为0.1mol,其质量为m=nM=0.1mol×160g·mol-1=16g;
,则Fe2O3的物质的量为0.1mol,其质量为m=nM=0.1mol×160g·mol-1=16g;
②溶解的Al(OH)3的质量为37g-21.4g=15.6g,其物质的量![]() 溶解Al(OH)3消耗了40mLNaOH,离子方程式为Al(OH)3+OH-=AlO2-
溶解Al(OH)3消耗了40mLNaOH,离子方程式为Al(OH)3+OH-=AlO2-![]() 。260mL时,H+、Fe3+、Al3+均完全反应,沉淀有Fe(OH)3和Al(OH)3,溶液中只有Na2SO4,可以根据原子守恒,求出H2SO4的物质的量浓度,有H2SO4~SO42-~2Na+,则c(NaOH)V(NaOH)=2c(H2SO4)V(H2SO4),5mol/L×0.26L=2×c(H2SO4)×0.1L,得c(H2SO4)=6.5mol/L。
。260mL时,H+、Fe3+、Al3+均完全反应,沉淀有Fe(OH)3和Al(OH)3,溶液中只有Na2SO4,可以根据原子守恒,求出H2SO4的物质的量浓度,有H2SO4~SO42-~2Na+,则c(NaOH)V(NaOH)=2c(H2SO4)V(H2SO4),5mol/L×0.26L=2×c(H2SO4)×0.1L,得c(H2SO4)=6.5mol/L。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】某溶液,只含以下离子中的若干种:K+、NH4+、Ba2+、Cl﹣、NO3﹣、SO42﹣,现取三份100mL溶液分别进行如下实验:
①第一份加入稀硝酸无明显现象,再加入AgNO3溶液有沉淀产生
②第二份加足量NaOH溶液后加热,收集到气体0.04mol
③第三份加足量BaCl2溶液后,得沉淀4.66g,加盐酸,沉淀质量不变。
根据以上实验,回答下列问题:
(1)溶液中不能确定是否存在的离子是_____,一定存在的阴离子是_____
(2)实验③间接表明溶液中不存在的离子是_____,实验②发生反应的离子方程式为_____
(3)小明根据上述实验认为该溶液中一定存在的阳离子为NH4+和_____,判断的依据是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气:KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目。________。
(2)将上述配平的化学方程式改写为离子方程式________。
(3)浓盐酸在反应中显示出来的性质是________。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)若产生0.5mol Cl2,则被氧化的HCl ____mol,转移的电子的数目约为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列说法正确的是( )
![]()
A.原子半径Q>R>T
B.原子序数比R多1的元素只能形成一种氢化物
C.W原子得电子能力强于Q原子,且可形成共价化合物QW2
D.与W同一主族的下一周期元素不可作为半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能的存储是氢能应用的主要瓶颈,开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①基态Ti2+中含有的电子数为______,电子占据的最高能级是______,该能级具有的原子轨道数为______。
②BH4-中B原子的杂化方式是______。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______ H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 | I4/kJmol-1 | I5/kJmol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
该氢化物的化学式为______。
(3)液氨是富氢物质,是氢能的理想载体。
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是 ______。
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,该化合物的结构式为 ______。
(4)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子。
①C60晶体易溶于苯、CS2,C60是 ______ 分子(填“极性”或“非极性”)。
②1mol C60分子中,含有σ 键数目为 ______ 个(阿伏加德罗常数用NA表示)。
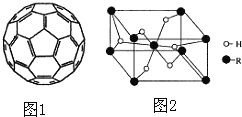
(5)某金属氢化物储氢材料的晶胞结构如图2所示,该金属氢化物的化学式为 ______,已知该晶体的密度为agcm-3,金属元素R的相对原子质量为M,阿伏加德罗常数为NA,则该晶胞的体积为 ______ cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
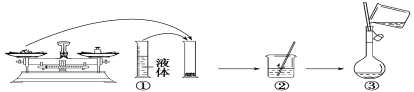
【题目】实验室需要480mL1mol·L-1NaOH溶液,根据溶液配制情况回答下列问题:
(1)实验中除了托盘天平(砝码)、药匙、量筒、烧杯、玻璃棒外还需要的其他仪器有___。
(2)如图是某同学在实验室配制该NaOH溶液的过程示意图,其中有错误的是___(填操作序号)。
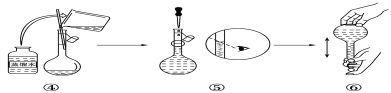
(3)下列操作会导致所配溶液的物质的量浓度偏高的是___。
A.配制NaOH溶液时,NaOH固体中含有Na2O杂质
B.用蒸馏水溶解NaOH固体后,立即转入容量瓶中定容
C.定容后发现液面高于刻线,可用胶头滴管将多余的水吸出
D.定容时仰视刻度线
E.用托盘天平称量 NaOH 固体时,砝码生锈
F.配制前容量瓶中有少量蒸馏水
(4)若某同学用密度为1.2g/cm3,质量分数为36.5%的浓盐酸配制100mL3mol/L的稀盐酸,需要用量筒量取浓盐酸的体积为___mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用黄铁矿烧渣为原料制备高档颜料—铁红(Fe2O3)的流程如下:
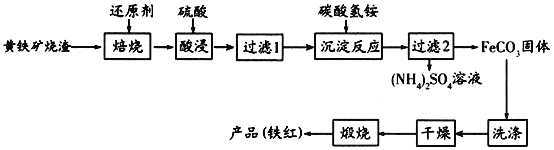
回答下列问题:
(1)“焙烧”时所添加的最佳还原剂是________(填序号)。
a.焦炭 b.硫黄 c.镁粉 d.锌粉
(2)“过滤1”后的滤液中溶质的主要成分是________________(填化学式)。
(3)“沉淀反应”时不宜混入过多空气,其原因为______________________(用离子方程式表示)。
(4)为检验FeCO3是否洗涤干净,可以向最后一次洗涤液中滴加________溶液。
(5)在空气中煅烧FeCO3生成铁红和另一种氧化物,反应的化学方程式为________。
(6)现有黄铁矿烧渣500t,铁元素的质量分数为16.8%,经过一系列转化后,得到90t铁红,该产品的产率为________。(提示:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: +4NaOH→CH2=CH2↑+NaCl+Na3PO4+3H2O。可用下述装置制取1,2-二溴乙烷(无色液体,密度2.18g·cm-3,熔、沸点为9.79℃、131.4℃,不溶于水);试管d中装有适量液溴(表面覆盖少量水)。
+4NaOH→CH2=CH2↑+NaCl+Na3PO4+3H2O。可用下述装置制取1,2-二溴乙烷(无色液体,密度2.18g·cm-3,熔、沸点为9.79℃、131.4℃,不溶于水);试管d中装有适量液溴(表面覆盖少量水)。
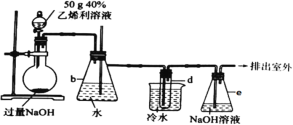
(1)e装置的作用是_______________;当观察到______________________________现象时,试管d中反应基本结束。
(2)若用冰水代替烧杯中的冷水,可能引起的不安全后果是_________________________。
(3)实验结束后精制试管d中粗产品,操作先后顺序是___________________。
A.蒸馏 B.水洗 C.用干燥剂干燥 D.10%NaOH溶液洗
(4)实验消耗40%乙烯利溶液50g,制得产品mg,则乙烯利合成1,2-二溴乙烷的产率为________________(列出含m的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把7.5 g镁铝合金的粉末放入200ml 4mol/L的盐酸中,往充分反应后的混合溶液中逐渐滴入一定物质的量浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积的关系如图所示。

(1)合金中镁的物质的量为_______。
(2)氢氧化钠的物质的量浓度为_______mol/L。
(3)V1=_______mL。
(4)写出该合金溶于足量NaOH溶液的化学方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com