
| A. | 物质的实验式就是其分子式 | |
| B. | 质谱法可以测定物质的相对分子量 | |
| C. | 从物质的红外光谱图可以获得分子中含有化学键或官能团的信息 | |
| D. | 从核磁共振氢谱图可以推知该有机物分子有几种不同类型的氢原子及他们的数目 |
分析 A.物质的实验式是组成原子的最简比;
B.质谱法中的最大值为该物质的相对分子质量;
C.红外光谱图常用来测定得分子中含有化学键或官能团的信息;
D.核磁共振氢谱图用来测定有机物分子中不同类型的氢原子及他们的数目之比.
解答 解:A.物质的实验式是组成原子的最简比,而分子式可能是实验式的倍比;故A错误;
B.质谱法中的最大值为该物质的相对分子质量,故B正确;
C.红外光谱图常用来测定得分子中含有化学键或官能团的信息,故C正确;
D.核磁共振氢谱图用来测定有机物分子中不同类型的氢原子及他们的数目之比,故D正确;
故选A.
点评 本题主要考查了研究物质的手段和技术,为高频考点,难度不大,注意不同仪器的用途.


科目:高中化学 来源: 题型:解答题
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 导管及仪器 |  |  |  |  |  |  |
| 每个橡皮塞上都打了两个孔 | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
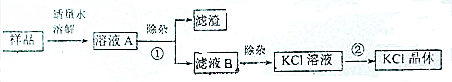
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHS溶液中:SO42-、K+、Cl-、Cu2+ | |
| B. | 在c(H+)/C(OH-)=1012的溶液中:NH4+、NO3-、K+、Cl- | |
| C. | 加入铝粉能放出H2的溶液中:Mg2+、NH4+、NO3-、Cl- | |
| D. | 通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的有效成分是Ca(ClO)2和CaCl2 | |
| B. | 漂白粉在空气中久置后会变质 | |
| C. | 漂白粉的有效成分Ca(ClO)2不稳定,易分解 | |
| D. | 漂白粉的主要成分是CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.15 mol/L•min | B. | v(H2)=0.1 mol/L•min | ||
| C. | v(N2)=0.1 mol/L•min | D. | v(N2)=0.002 mol/L•s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 置换反应的通式可表示为如图所示:请回答下列问题:
置换反应的通式可表示为如图所示:请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
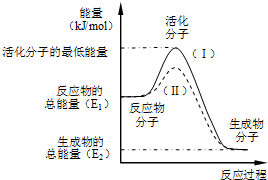 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com