
【题目】常温下,向浓度为0.1 mol·L-1、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。据图信息回答:

(1)该温度时NH3·H2O的电离常数K=________。
(2)比较b、c、d三点时的溶液中,由水电离出的c(OH-)大小顺序为________。
【答案】10-5 d>c>b
【解析】
(1)根据开始时pH计算c(H+),再根据Kw中c(H+)、c(OH-)的关系计算溶液的c(OH-),结合NH3·H2O的电离平衡计算平衡时溶液的各种微粒的浓度,代入平衡常数表达式,可计算出K的大小;
(2)滴定时,由b点到c点的过程中,根据水的离子积常数、氨水的电离平衡、氯化铵的水解平衡只与温度有关来分析。
(1)滴定前氨水pH=11,则溶液中c(H+)=10-11mol/L,利用水的离子积得c(OH-)=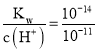 mol/L=10-3mol/L,在氨水中存在电离平衡:NH3·H2O
mol/L=10-3mol/L,在氨水中存在电离平衡:NH3·H2O![]() NH4++OH-,则一水合氨的电离平衡常数K=
NH4++OH-,则一水合氨的电离平衡常数K= =
=![]() ≈10-5;
≈10-5;
(2)在b点时,溶质为氨水和氯化铵,氨水的电离程度大于氯化铵的水解程度,溶液为碱性,对水的电离平衡起到抑制作用;
在c点时,溶质为氨水和氯化铵,氨水的电离程度等于氯化铵的水解程度,溶液为中性,对水的电离平衡无影响;
在d点时,溶质为氯化铵,氯化铵发生水解,使溶液显酸性,对水的电离平衡起促进作用,所以b、c、d三点时的溶液中,水电离的c(OH-)大小顺序是:d>c>b。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】反应COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④B.①④⑥C.②③⑤D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某盐溶液NaHR的电离方程式为NaHR=Na++HR-下列有关说法不正确的是
A.Na2R溶液的pH值一定大于7
B.若NaHR溶液中c( OH-)>c( R2-)则溶液呈碱性
C.c(Na+)>c(HR-)>c( R2-)>c(OH-)>c( H+)
D.NaHR溶液的pH值不一定大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续合成氨,其原理如下图所示。下列说法不正确的是
A. 过程I得到的Li3N中N元素为—3价
B. 过程Ⅱ生成W的反应为Li3N+3H2O===3LiOH+NH3↑
C. 过程Ⅲ中能量的转化形式为化学能转化为电能
D. 过程Ⅲ涉及的反应为4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
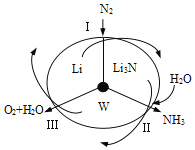
【题目】pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液A、B的pH与溶液体积(V)的关系如下图所示:
(1)稀释前起始浓度大小关系:c(A)_____c(B)(填“>”、“<”、“=”)
(2)稀释前向两溶液中分别投入足量锌,开始放H2的速率A_______B,最终得H2体积 A______B。(填“<”“>”“=”)
(3)若使稀释后所得两溶液的pH重新相等,加水量_____________多。
查看答案和解析>>
科目:高中化学 来源: 题型:
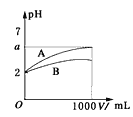
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,两个恒容密闭容器中仅发生反应2NO2(g)![]() 2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
容器 编号 | 起始浓度(mol·L1) | 平衡浓度(mol·L1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.6 | 0.1 | 0 | |
下列说法不正确的是
A.Ⅰ中NO2的平衡转化率约为66.7%
B.Ⅱ中达到平衡状态时,c(O2)<0.2 mol·L1
C.该反应的化学平衡常数可表示为K=![]()
D.升高温度,该反应的化学平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中铋元素的数据如图,下列说法正确的是( )
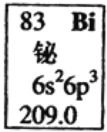
A. Bi元素的质量数是209
B. Bi元素的相对原子质量是209.0
C. Bi原子6p亚层有一个未成对电子
D. Bi原子最外层有5个能量相同的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应4NH3(g)+ 5O2(g)![]() 4NO(g)+ 6H2O(g),下列叙述正确的是( )
4NO(g)+ 6H2O(g),下列叙述正确的是( )
A.任意时刻:3υ正(NH3)= 2υ正(H2O)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C.达到化学平衡时,增大压强,则逆反应速率增大,正反应速率减小
D.达到化学平衡时,5υ正(O2)= 4υ逆(NO )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com