
| A. | 反应完成后,O2有剩余 | |
| B. | 原混合气体中,C2H4与C2H2的体积共为1.9L | |
| C. | 反应完成后,生成水的质量为9g | |
| D. | 原混合气体中,CO与CH4的体积比一定为1:1 |
分析 A.用极值法判断,当完全为乙烯时消耗氧气体积最大,据此判断氧气是否过量;
B.根据生成二氧化碳的体积判断乙烯和乙炔的总体积;
C.题中数据无法判断甲烷、乙烯和乙炔的体积,则无法计算水的物质的量、质量;
D.能够计算出CO和甲烷的总体积,但是无法计算二者的具体体积.
解答 解:A.根据物质分子构成知,5.6L由CO、CH4、C2H4、C2H2组成的混合气体完全燃烧,当完全为乙烯时消耗氧气体积最大,最大体积为:5.6L×$\frac{5}{2}$=14L<18L,所以反应后氧气有剩余,故A正确;
B.根据C原子守恒,二氧化碳比原气体增大的体积即为乙烯和乙炔的体积,则生成二氧化碳体积比混合物体积增大了:7.5L-5.6L=1.9L,所以乙烯和乙炔的总体积为1.9L,故B正确;
C.题干信息无法判断CH4、C2H4、C2H2的体积,则无法计算反应后生成水的物质的量,故C错误;
D.根据B可知,混合气体中CO和甲烷的总体积为:5.6L-1.9L=3.7L,但是题中数据无法计算一氧化碳和甲烷的具体体积,故D错误;
故选AB.
点评 本题考查混合物的有关计算,为高频考点,采用极限法、差量法来分析解答即可,侧重考查学生分析计算能力,题目难度中等.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ①③ | C. | ①③⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol | B. | 0.15mol | C. | 0.25mol | D. | 0.3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
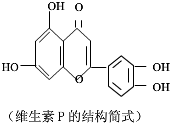
| A. | 可与NaOH溶液反应,1mol该物质可与4mol NaOH反应 | |
| B. | 可与溴水反应,且1mol该物质与足量溴水反应消耗6mol Br2 | |
| C. | 一定条件下1mol该物质可与H2加成,耗H2最大量为7mol | |
| D. | 维生素P遇FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
| 结构式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH | (CH3O)2CO |
| 沸点(℃) | 64.7 | 7.4 | 153℃ | -24.9 | 90℃ |
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
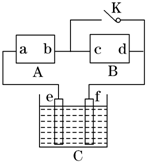 如图所示,A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图所示,A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com