
| 实验 序号 | 体积V/ml | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
分析 (1)根据KI、Na2S2O3与淀粉的反应原理解答,注意反应过程的快慢问题;
(2)根据实验目的及表格数据分析,从而确定Vx的大小及理由,注意探究物质的量浓度对反应速率影响时,其它条件应相同;
(3)①锰离子有催化作用;
②要想验证锰离子的催化作用,再加入硫酸锰即可.
解答 解:(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,先发生S2O82-+2I-═2SO42-+I2(慢),后发生I2+2S2O32-═S4O62-+2I- (快),当S2O32-耗尽后,碘才能与淀粉作用显示蓝色,根据I2+2S2O32-═S4O62-+2I- (快)方程式知,I2与S2O32-的物质的量的关系为1:2,即1mol碘需2molS2O32-,根据方程式S2O82-+2I-═2SO42-+I2知,生成1mol碘需为1molS2O82-,即n(S2O82-):n(S2O32-)=1:2,确保能观察到蓝色,碘需有剩余,即n(S2O82-):n(S2O32-)$>\frac{1}{2}$,
故答案为:无色;蓝色;$>\frac{1}{2}$;
(2)对照实验1和2发现,实验2取的0.20mol•L-1K2S2O8溶液的体积9mL,比实验1少了1mL,说明取的K2S2O8物质的量少,加水1mL,保证了溶液的体积不变,所以在其它条件不变的情况下,探究的是该反应速率与K2S2O8浓度的关系,同样原理对照实验1和3,为保证溶液的体积相同,须加2mL水,
故答案为:2.0;保证反应物K2S2O8浓度改变,而其他的条件不变,才能达到实验目的;
(3)①KMnO4与H2C2O4反应生成硫酸锰,锰离子有催化作用,所以猜想还可能是催化剂的作用,
故答案为:生成的锰离子有催化作用;
②要想验证锰离子的催化作用,在做对比实验时同时加入硫酸锰观察反应速率是否变化即可,不能加入氯化锰,阴离子氯离子对实验有干扰,
故答案为:C.
点评 本题考查了实验探究,注意探究外界条件对化学反应影响时,只能改变一个条件,其它条件必须相同,否则不能得出正确结论,注意对实验现象的分析,


科目:高中化学 来源: 题型:选择题
| A. | 不能与氧气反应 | B. | 储存巨大能量 | ||
| C. | 是氢的一种同素异形体 | D. | 内部存在自由移动的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀NaOH溶液中通入Cl2:Cl2+2OH-═ClO-+Cl-+H2O | |
| B. | 向Fe2(SO4)3溶液中加入铜粉:2Fe3++3Cu═2Fe+3Cu2+ | |
| C. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 向氨水中通入过量SO2:SO2+OH-═HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | H2C2O4溶液 | 酸性KMnO溶液 | 温度℃ | ||
| 浓度/(mol•L-1) | 体积/mL | 浓度/(mol•L-1) | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.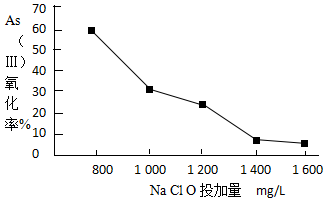
| pH | <2 | 2~7 | 7~11 | 11~14 |
| 存在形式 | H3AsO4 | H2AsO3- | HAsO42- | HAsO42-、AsO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
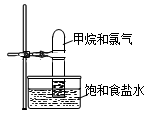 将如图装置放置在光亮的地方,随后观察到如下实验现象:大试管内壁上有油状液滴生成、饱和食盐水中有少量固体析出、黄绿色气体颜色变浅、试管内液面有所上升.
将如图装置放置在光亮的地方,随后观察到如下实验现象:大试管内壁上有油状液滴生成、饱和食盐水中有少量固体析出、黄绿色气体颜色变浅、试管内液面有所上升.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精灯外焰加热铝箔,铝箔熔化但不滴落,说明Al2O3的熔点比Al的熔点高 | |
| B. | 锅炉水垢CaSO4可用Na2CO3溶液浸泡,再用酸溶解去除,说明Ksp:CaCO3>CaSO4 | |
| C. | 用酸性KMnO4溶液验证草酸的还原性 | |
| D. | 向滴有KSCN的FeCl3溶液中加入NaOH溶液以研究反应物浓度对化学平衡的影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com