
【题目】无色气体A在一种黄绿色气体B中可以安静的燃烧,发出苍白色火焰,反应生成气体C。B与金属D反应可生成白色固体E,D在空气中燃烧生成浅黄色固体F,F与CO2反应可得到气体G,D与水反应可生成A,A在G中燃烧生成水。推断出各种物质后,回答下列问题:
(1)写出下列物质的化学式:B _______、C_______、E_______。
(2)写出下列化学方程式:
a.由D生成F:___________________________________________________;
b.F与CO2反应:__________________________________________________;
c.D与水反应:____________________________________________________。
【答案】(9分)(1)Cl2HCl NaCl (每空1分)
(2)2Na+O2![]() Na2O2
Na2O2
2Na2O2+2CO2===2Na2CO3+O2
2Na+2H2O===2NaOH+H2↑ (每空2分)
【解析】
试题本题考查无机推断和化学方程式的书写。气体B为黄绿色,气体B为Cl2;气体A在Cl2中燃烧发出苍白色火焰,气体A为H2,H2与Cl2反应生成的气体C为HCl;金属D在空气中燃烧浅黄色固体,金属D为Na,生成的浅黄色固体F为Na2O2;Na2O2与CO2反应生成的气体G为O2。Cl2与Na生成的白色固体E为NaCl。
(1)B的化学式为Cl2,C的化学式为HCl,E的化学式为NaCl。
(2)a.D生成F的化学方程式为:2Na+O2![]() Na2O2。
Na2O2。
b.F与CO2反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2。
c.D与水反应的化学方程式为:2Na+2H2O=2NaOH+H2↑。


科目:高中化学 来源: 题型:
【题目】下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)
物质 | 除杂试剂 | 操作 | |
A | CO2 (HCl) | 氢氧化钠溶液 | 洗气 |
B | FeCl2 溶液 (FeCl3) | 铜粉 | 充分反应后过滤 |
C | Na2CO3固体(NaHCO3) | 无 | 充分加热 |
D | Fe2O3 (Al2O3) | 稀硫酸 | 充分反应后过滤 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解饱和NaCl溶液是化学工业的重要反应之一。20℃时,饱和NaCl溶液的密度为ρg·cm-3,物质的量浓度为cmol·L-1,则下列说法中不正确的是( )
A. 温度高于20℃时,饱和NaCl溶液的密度大于ρg·cm-3
B. 此溶液中NaCl的质量分数为58.5c/(1000ρ)%
C. 20℃时,浓度小于c mol·L-1的NaCl溶液是不饱和溶液
D. 20℃时,饱和NaCl溶液的溶解度S=5850c/(1000ρ-58.5c)g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为
ρ g·cm-3,质量分数为w,其中含NH![]() 的物质的量为b mol。下列叙述中正确的是( )
的物质的量为b mol。下列叙述中正确的是( )
A. 溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
B. 溶质的质量分数为w=![]() ×100%
×100%
C. 溶液中c(OH-)=![]() mol·L-1
mol·L-1
D. 上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )

A. 分子式为C7H6O5
B. 分子中含有2种官能团
C. 可发生加成和取代反应
D. 在水溶液中羧基和羟基均能电离出H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾在高温下易分解,用右图装置检验绿矾的分解产物(加热装置已略去)。化学方程式为:2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O。二氧化硫的沸点为-10℃,三氧化硫的沸点为44.8℃。其中b为干燥的试管。下列有关说法不正确的是
Fe2O3+SO2↑+SO3↑+14H2O。二氧化硫的沸点为-10℃,三氧化硫的沸点为44.8℃。其中b为干燥的试管。下列有关说法不正确的是
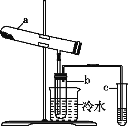
A. SO2是还原产物,Fe2O3是氧化产物
B. b中所得到的硫酸的质量分数理论上为29.5%
C. 将反应后的气体通入氯化钡溶液中,产生的沉淀为BaSO3、BaSO4
D. 将反应后的气体通入硝酸钡溶液中,产生的沉淀为只有BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W均为元素周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质。回答下列问题(相关问题均用元素符号或化学式表示):
(1)R的基态原子的核外电子排布式是_____________________。
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是_______________。
(3)X与Z中电负性较大的是_________;Z的某种含氧酸盐常用于实验室中X单质的制取,此酸根离子的空间构型是__________,此离子中含有的化学键类型是__________;X—Z—X的键角______109°28'(填“>”“<”或“=”)
(4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为_______,以距离一个X离子最近的所有Y离子为顶点构成的几何体为________。该化合物与MgO相比,熔点较高的是____________。
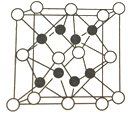
(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为_________g/cm3。(列算式,不必计算出数值,阿伏伽德罗常数的数值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列化学反应在理论上可以设计成原电池的是____________。
A.C(s)+H2O(g)![]() CO(g)+H2(g) △H>0
CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)![]() NaC1(aq)+H2O(1) △H<0
NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)![]() 2H2O(1) △H<0
2H2O(1) △H<0
(2)以H2SO4溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com