
【题目】钴的合金及其配合物用途非常广泛。
(1) Co3+基态核外电子排布式为________。
(2) 一种Pt、Co金属间化合物可作为质子交换膜燃料电池的催化剂,其晶胞结构如图所示,该金属间化合物的化学式为________。

(3) BNCP可用于激光起爆器等,BNCP可由HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为________ (用文字描述)。
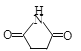
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co(Ⅲ)形成配位键的原子是________ (已知CO32-的结构式为![]() )。
)。
③NaNT可由![]() (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为________,1 mol该分子中含σ键的数目为________。
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为________,1 mol该分子中含σ键的数目为________。
【答案】[Ar]3d6或1s22s22p63s23p63d6 Pt3Co 正四面体 N和O sp和sp2 9 NA
【解析】
(1)Co元素为27号元素,Co原子失去4s能级上2个电子、3d能级上1个电子生成Co3+,根据构造原理书写该离子核外电子排布式为1s22s22p63s23p63d6或[Ar]3d6;
(2)根据均摊法,该晶胞中Pt原子的个数为![]() =3,Co原子个数为
=3,Co原子个数为![]() =1,所以化学式为Pt3Co;
=1,所以化学式为Pt3Co;
(3)①ClO4-的中心原子价层电子对数为![]() =4,不含孤电子对,所以空间构型为正四面体;
=4,不含孤电子对,所以空间构型为正四面体;
②CTCN的化学式为[Co(NH3)4CO3]NO3,内界为[Co(NH3)4CO3]+,NH3分子中N原子含有孤电子对,根据碳酸根的结构式可知O原子有孤电子对,所以与Co(Ⅲ)形成配位键的原子是N和O;
③双聚氰胺C原子分别形成三键和双键,所以为sp杂化和sp2杂化;双键中有一个σ键,三键中有一个σ键,单键均为σ键,所以1 mol该分子中含σ键的数目为9 NA。


科目:高中化学 来源: 题型:
【题目】某干电池的工作原理如图所示,总反应为:![]() ,下列说法正确的是
,下列说法正确的是
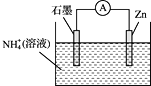
A.石墨为电池的负极
B.电池工作时![]() 被氧化
被氧化
C.实现了电能向化学能转化
D.电子由Zn电极经外电路流向石墨电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然氨基酸M是人体必需的氨基酸之一,其合成路线如下:

已知:
①![]()
![]()
②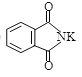 +R—X→
+R—X→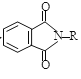 +KX
+KX
(1)A→B的反应条件和试剂是__________________;
(2)I→J的反应类型是______________;
(3)写出G与NaOH水溶液反应的化学方程式________________________________;
(4)化合物M缩聚生成高分子化合物N化学方程式___________;
(5)符合下列条件的化合物M的同分异构体共有__________种(不考虑立体异构);
①含有苯甲酸结构 ②含有一个甲基 ③苯环上只有2个取代基
其中核磁共振氢谱峰面积比为1:1:2:2:2:3的分子的结构简式________________(任写一种);
(6)请写出以丙酸和上述流程中出现的物质为原料经三步合成丙氨酸(![]() )的路线。________________________________________________________________________________
)的路线。________________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定Fe2O3和Cu混合物的组成(假设混合均匀),某兴趣小组称取五份不同质量的样品,分别投入30.0 mL某浓度的稀硫酸中。充分反应后,每组样品剩余固体的质量与原样品质量的关系如图所示。
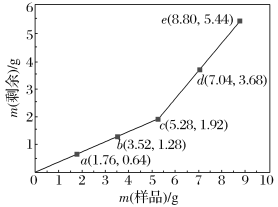
(1)n(Fe2O3)∶n(Cu)=________。
(2)稀硫酸的浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】健康人体内含铁元素大约2~3g,人体内铁元素以亚铁离子和三价铁离子的形式存在,Fe2+易被吸收,所以给贫血者补充铁元素时,应补充含Fe2+的亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

(1)试剂1的名称是__,试剂2的名称是__。
(2)加入新制氯水,溶液中发生反应的离子方程式是__。
(3)加入试剂2时溶液为淡红色说明“速力菲”中的Fe2+已部分氧化,一般在服用“速力菲”时,同时服用维生素C,说明维生素C具有__性。
(4)不仅溶液中Fe2+易被氧化成Fe3+,溶液中白色沉淀Fe(OH)2更易被O2氧化,请写出反应的化学方程式___,现象为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)常用作有机合成的氯化剂、催化剂和阻燃剂等。POCl3遇水会强烈水解,生成H3PO4和HCl。为测定某POCl3样品中Cl元素含量,进行下列实验:
①准确称取30.70 g POCl3样品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解;
②将水解液配成100.00 mL溶液A,取10.00 mL溶液A于锥形瓶中;
③加入10.00 mL 3.200 mol·L-1 AgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;
④加入指示剂,用0.200 0 mol·L-1 KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN溶液。
已知:AgSCN是白色沉淀,Ksp(AgSCN)=2×10-12,Ksp(AgCl)=1.8×10-10。
(1) 滴定选用的指示剂是________ (填字母);滴定终点的现象为________。
A. FeCl2 B. NH4Fe(SO4)2 C. 淀粉 D. 甲基橙
(2) 用硝基苯覆盖沉淀的目的是________;若无此操作,所测Cl元素含量将会________ (填“偏大”、“偏小”或“不变”)。
(3) 计算三氯氧磷样品中Cl元素的含量________ (写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。工业上可通过以下反应制得ClO2(提示:下面方程式中的氧元素都为负二价)2KClO3+Na2SO3+H2SO4![]() 2ClO2↑+K2SO4+Na2SO4+H2O,则下列说法中正确的是
2ClO2↑+K2SO4+Na2SO4+H2O,则下列说法中正确的是
A. KClO3在反应中是还原剂
B. 制得1mol的ClO2反应中需转移2mol电子
C. Na2SO3的还原性小于ClO2的还原性
D. 反应中被氧化的元素是S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、 Z、W、Q、 M在元素周期表的相对位置如图所示,其中Z元素是目前发现的非金属性最强的元素,下列说法正确的是
X | Y | Z | |
W | Q | M |
A. 对应氢化物的沸点Y> Q是因为Y的非金属性比Q强
B. XM4的比例模型为![]() 其二氢取代物有两种
其二氢取代物有两种
C. W的氧化物,常温下可以和Z、M的氢化物反应
D. Z的单质能将Y的单质从他的氢化物中置换出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)![]() C8H8(g)+H2(g) ΔH=+125kJ·mol-1
C8H8(g)+H2(g) ΔH=+125kJ·mol-1
Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)该温度下,该反应的化学平衡常数K=________________。
(2)若保持其他条件不变,用0.40molH2(g)和0.40molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是________________,通过计算说明此时,该反应是否达到了平衡状态__________?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com