
科目:高中化学 来源:不详 题型:单选题
| A.将FeCl3溶液加热蒸干,并灼烧最终得到Fe2O3 |
| B.25oC时CH3COONa溶液的Kw大于100OC时CH3COONa溶液的Kw |
| C.100OC时,将PH=2的盐酸与PH=12的NaOH溶液等体积混合,溶液呈中性 |
| D.一般而言,弱电解质的浓度越大,其电离度越小,电离常数也越小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲酸与水能以任意比混溶 |
| B.甲酸能与Na2CO3溶液反应,生成CO2气体 |
| C.1mol/L的HCOOH水溶液能使紫色石蕊试液变红 |
| D.1mol/L的HCOONa溶液的pH约为8.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.H2S 2H+ + S2- 2H+ + S2- | B.HClO = H+ +ClO- |
C.CH3COONH4 NH4+ +CH3COO- NH4+ +CH3COO- | D.HCO3—+H2O  H3O++CO32- H3O++CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.先配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 |
| B.先测0.10 mol/L CH3COOH溶液的pH,然后将其加热至40℃,再测pH,如果pH变小,则可证明醋酸为弱电解质 |
| C.先配制一定量0.01 mol/L和0.10 mol/L的CH3COOH溶液,分别测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸为弱电解质 |
| D.在常温下,配制一定量的CH3COONa溶液,测其pH,若pH大于7,则可证明醋酸为弱电解质。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | 镁的质量 | 酸量 | 开始的反应速率 | 产生H2总量 |
| Ⅰ | 0.24g | HCl: 0.2 mol/L 100mL | ν1 | n1 |
| Ⅱ | 0.24g | CH3COOH:0.2 mol/L 100mL | ν2 | n2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CO32-、Cl-、OH-、SO42- |
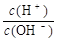 = 。
= 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com