
分析 (1)①原料OF2中氟的电负比氧强,所以氧元素的化合价显正价,氟元素显负价;
②由①知NF3中氮元素的化合价为+3,而反应中每消耗1molN2转移7mol电子,用待定系数和得失电子守恒分析解答;
(2)①Ⅰ、(NH4)3AlF6+6F2═2NH3+8HF+NH4AlF4;Ⅱ、NH4AlF4+3F2═NF3+4HF+AlF3
消去中间产物NH4AlF4,Ⅰ+Ⅱ得总反应方程式为(NH4)3AlF6+9F2═3NF3+12HF+AlF3,同时得当有0.5mol (NH4)3AlF6完全被氧化可得1.5molNF3,根据V=nVm进行计算;
②由反应方程式(NH4)3AlF6+9F2═3NF3+12HF+AlF3可知,制备3molNF3,共转移18mol电子,因此制备1.5molNF3,共有9mol电子发生转移;
(3)①电解过程中阳极发生氧化反应;
②阳极上能发生氧化反应的微粒还有F-,所以F-发生氧化反应后得F2;
(4)NF3与空气中的水蒸气反应的产物有HF、NO和HNO3,NO遇空气呈红综色,同时氢氟酸、硝酸小液滴在空气中产生白雾.
解答 解:(1)①由于氟的非金属性强于氧的,氟和氧成键时共用电子对偏向氟,因此OF2中氧元素呈+2价,故答案为:+2;
②OF2中氧元素呈+2价,同理知NF3中氮元素的化合价为+3,根据题意知OF2+N2+O2→NO2+NF3,设当有1molN2反应时,生成NO2xmol,NF3ymol,根据N原子守恒得x+y=2,根据得失电子守恒得4x+3y=7,联立解得x=y=1,由此可知反应的化学方程式为6OF2+4N2+O2═4NO2+4NF3,故答案为:6,4,1,4,4;
(2)①Ⅰ、(NH4)3AlF6+6F2═2NH3+8HF+NH4AlF4;Ⅱ、NH4AlF4+3F2═NF3+4HF+AlF3
消去中间产物NH4AlF4,Ⅰ+Ⅱ得总反应方程式为(NH4)3AlF6+9F2═3NF3+12HF+AlF3,同时得当有0.5mol (NH4)3AlF6完全被氧化可得1.5molNF3,则V=nVm=1.5mol×22.4L/mol=33.6L,故答案为:33.6L;
②由反应方程式(NH4)3AlF6+9F2═3NF3+12HF+AlF3可知,制备3molNF3,共转移18mol电子,因此制备1.5molNF3,共有9mol电子发生转移,故答案为:9;
(3)①电解过程中阳极发生氧化反应,因为NF3是NH4+在阳极被氧化所得,电极反应式为NH4+-6e-+3F-═NF3↑+4H+,故答案为:NH4+-6e-+3F-═NF3↑+4H+;
②阳极上能发生氧化反应的微粒还有F-,所以F-发生氧化反应后得F2,故答案为:F2;
(4)NF3与空气中的水蒸气反应的产物有HF、NO和HNO3,NO遇空气呈红综色,同时氢氟酸、硝酸小液滴在空气中产生白雾,所以现象为:有红棕色气体和白雾产生,故答案为:观察到有红棕色气体和白雾产生.
点评 本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本概念及转移电子数目的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | nCH2=CHCH2COOH→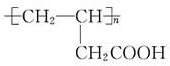 | |
| B. | nHOOC(CH2)5OH?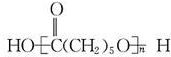 +(n-1)H2O +(n-1)H2O | |
| C. | n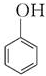 +nHCHO$\stackrel{H+}{→}$ +nHCHO$\stackrel{H+}{→}$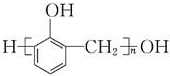 +(2n-1)H2O +(2n-1)H2O | |
| D. | nHOOC(CH2)4COOH+nHO(CH2)2OH?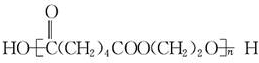 +(2n-1)H2O +(2n-1)H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 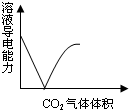 CO2通入澄清石灰水 | B. | 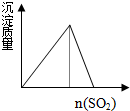 水玻璃中通入SO2 | ||
| C. | 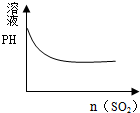 氯水中通入SO2 | D. | 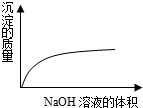 NaOH溶液滴入Ba(HCO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
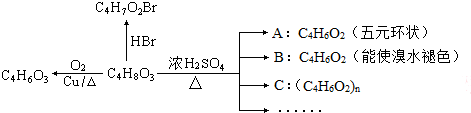
 +H2O;
+H2O; .合成路线示例如下:
.合成路线示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都可以与溴发生取代反应 | |
| B. | 乙烯易发生加成反应,苯不能发生加成反应 | |
| C. | 常温下都是气态物质 | |
| D. | 乙烯易被酸性高锰酸钾溶液氧化,而苯不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com