
| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 对CO(g)+NO2(g)═CO2(g)+NO(g)平衡体系增大压强可使其颜色变深 | |
| C. | 常温下,将1mLpH=3的醋酸溶液加水稀释到100mL,测得其pH<5 | |
| D. | 实验室中常用排饱和食盐水的方法收集氯气 |
分析 平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用.
解答 解:A.存在平衡H2CO3?H2O+CO2,打开瓶盖时,压强减小,平衡向右移动,二氧化碳气体溶解度减小,逸出二氧化碳,可以用平衡移动原理来解释,故A不选;
B、对平衡CO(g)+NO2(g)?CO2(g)+NO(g),两边气体计量数相等,增大压强平衡不移动,不能用勒夏特列原理解释,故B选;
C、醋酸是弱电解质存在电离平衡,加水稀释促进电离,体积变化和定量平衡正向进行,共同决定溶液PH,将1mL pH=3的醋酸溶液加水稀释至100mL,测得其pH<5,能用勒沙特列原理解释,故C不选;
D、实验室可用排饱和食盐水的方法收集氯气,氯气和水的反应是可逆反应,饱和氯化钠溶液中氯离子浓度大,化学平衡逆向进行,减小氯气溶解度,能用勒沙特列原理解释,故D不选,
故选B.
点评 本题考查勒夏特例原理应用的有关判断,是高考中的常见题型和考点,属于中等难度试题的考查,侧重对学生解题能力的培养与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,该题需要明确的应注意区别化学平衡移动原理和化学反应速率理论的应用范围,并能具体问题、具体分析加快.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 0.9 mol | B. | 0.8 mol | C. | 0.7 mol | D. | 0.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | 液氮 | 纯碱 | 食盐水 |
| B | 金刚石 | 火碱 | 碘酒 |
| C | 硫粉 | 氢氧化铝 | Na2CO3•10H2O |
| D | 干冰 | 明矾 | 石油 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | NaCl NaBr | C. | NaCl NaBr NaI | D. | NaCl NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:Cr2O${\;}_{7}^{2-}$、Fe3+、SCN-、Cl- | |
| B. | 能使石蕊呈蓝色的溶液中:Na+、K+、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$ | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012 的溶液中:S2O${\;}_{3}^{2-}$、CrO${\;}_{4}^{2-}$、Cl-、Mg2+ | |
| D. | 水电离的c (H)=10-12mol•L-1 的溶液中:HCO${\;}_{3}^{-}$、SiO${\;}_{3}^{2-}$、Cu2+、NH${\;}_{4}^{+}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读如图,K闭合时下列判断不正确的是( )
铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读如图,K闭合时下列判断不正确的是( )| A. | d电极:PbSO4+2H2O-2e-=PbO2+4H++SO42- | |
| B. | 当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol | |
| C. | Ⅱ中SO42-向c电极迁移 | |
| D. | K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
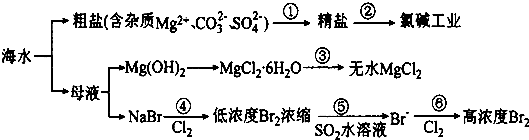
| A. | 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 | |
| B. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 | |
| C. | 在过程④、⑥反应中每氧化0.2 mol Br一需消耗2.24LCl2 | |
| D. | 在过程③中将MgCl2.6H2O灼烧即可制得无水MgCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com