
| 功率 |
| U |
| 5g |
| 65g/mol |
| 1 |
| 13 |
| 1 |
| 13 |
| 2 |
| 13 |
| 2 |
| 13 |
| Q |
| I |
| 功率 |
| U |
| 40×10-6A |
| 0.8V |
| 5g |
| 65g/mol |
| 1 |
| 13 |
| 1 |
| 13 |
| 2 |
| 13 |
| 2 |
| 13 |
| Q |
| I |
| 14818.46C |
| 5.0×10-5A |


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
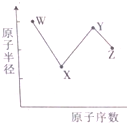 短周期元素W、X、Y和Z的原子半径随原子序数的变化如图所示.在周期表中,W和X的族序数之和等于Z的族序数.其中X的单质是空气的成分之一,元素Y是地壳中含量最丰富的金属元素,元素Z的原子最外层电子数是其电子层数的2倍.下列叙述不正确的是( )
短周期元素W、X、Y和Z的原子半径随原子序数的变化如图所示.在周期表中,W和X的族序数之和等于Z的族序数.其中X的单质是空气的成分之一,元素Y是地壳中含量最丰富的金属元素,元素Z的原子最外层电子数是其电子层数的2倍.下列叙述不正确的是( )| A、W的简单离子半径小于氢元素的简单阴离子的半径 |
| B、Y与Z形成的化合物可以通过溶液中复分解获取 |
| C、运输Z的最高价氧化物对应水化物的浓溶液可用Y单质材料容器 |
| D、X的简单氢化物的沸点比Z的简单氢化物的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 电解池、原电池对于金属冶炼、实验室研究具有十分重要的意义.
电解池、原电池对于金属冶炼、实验室研究具有十分重要的意义. (R、R表示烃基)则该原电池的负极反应式为
(R、R表示烃基)则该原电池的负极反应式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑦ | B、②⑥ |
| C、③⑤ | D、只有① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④⑥ | B、①⑤⑥ |
| C、②③④ | D、①⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、2:1 |
| C、1:2 | D、2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、电子式  可以表示羟基.也可以表示氢氧根离子 可以表示羟基.也可以表示氢氧根离子 |
B、比例模型 可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 |
C、原子结构示意图 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
D、结构示意图为 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com