
已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以缓慢结合的方式进行的,具有高度特异性,其分子结构如下所示。

下列说法正确的是( )
A.该物质的分子式为C12H20N4O7
B.1 mol该物质与NaOH溶液反应,可以消耗4 mol NaOH
C.在一定条件下,该物质可以发生消去、加成、取代等反应
D.该物质能使溴水或酸性高锰酸钾溶液褪色,能与FeCl3溶液发生显色反应
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)同周期元素,从左到右,原子半径逐渐减小,离子半径也逐渐减小( )
(2)电子层数越多,半径越大( )
(3)在主族元素中,最高正化合价均等于主族序数( )
(4)元素的原子得电子越多,非金属性越强;失电子越多,金属性越强( )
(5)元素的氧化物对应的水化物酸性越强,非金属性越强;碱性越强,金属性越强( )
(6)元素的气态氢化物越稳定,非金属性越强,其水溶液的酸性越强,还原性越弱( )
(7)在Mg、Al、NaOH溶液构成的原电池中,因为Al作负极,Mg作正极,所以Al的金属性大于Mg( )
查看答案和解析>>
科目:高中化学 来源: 题型:
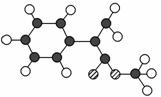 A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图所示(图中球与球之间连线代表单键或双键)。
A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图所示(图中球与球之间连线代表单键或双键)。
Ⅰ.根据分子结构模型写出A的结构简式______________________________________________________。
Ⅱ.拟从芳香烃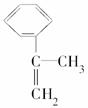 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下:
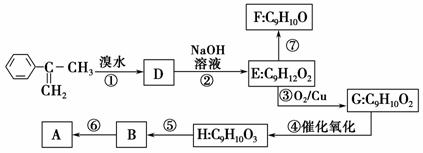
已知:A在酸性条件下水解生成有机物B和甲醇。
(1)写出⑤的反应类型_______________________________________。
(2)写出H的结构简式_______________________________。
(3)已知F分子中含有“—CH2OH”,通过F不能有效、顺利地获得B,其原因是___________________________________________________。
(4)写出反应方程式(注明必要的反应条件):
⑥___________________________________________________________;
⑦________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下:
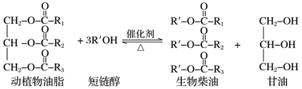
下列叙述错误的是( )
A.生物柴油由可再生资源制得
B.生物柴油是不同酯组成的混合物
C.动植物油脂是高分子化合物
D.“地沟油”可用于制备生物柴油
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于蛋白质的说法不正确的是 ( )
A.蛋白质是天然高分子化合物
B.通常用酒精消毒,其原理是酒精使细菌中的蛋白质变性而失去生理活性
C.浓的Na2SO4溶液能使溶液中的蛋白质析出,加水后析出的蛋白质又溶解,但已失去生理活性
D.鉴别织物成分是蚕丝还是“人造丝”可采用灼烧闻气味的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中需要22.4 L(标准状况)SO2气体。化学小组同学依据化学方程式Zn+2H2SO4(浓)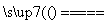 ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
(1)化学小组所制得的气体中混有的主要杂质气体可能是______(填分子式)。产生这种结果的主要原因是________(用化学方程式和必要的文字加以说明)。
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。
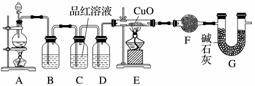
①装置B中加入的试剂为________,作用是________。
②装置D加入的试剂为________________,装置F加入的试剂为________________。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是________。
④U形管G的作用为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某合作小组同学将铜片加入稀硝酸中,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。
(1)该反应的离子方程式为______________________________________。
(2)提出合理假设,该实验中反应速率明显加快的原因可能是______(填字母)。
A.反应放热导致温度升高
B.压强增大
C.生成物的催化作用
D.反应物接触面积增大
(3)初步探究,测定反应过程中不同时间溶液的温度,结果如表所示:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
结合实验目的和表中数据,你得出的结论是__________________________。
(4)进一步探究:查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用。请完成以下实验设计表并将实验目的补充完整:
| 实验编号 | 铜片质量/g | 0.1 mol·L-1的硝酸体积/mL | 硝酸铜晶体/g | 亚硝酸钠晶体/g | 实验目的 |
| ① | 5 | 20 | 实验①和②探究____的影响;实验①和③探究NO | ||
| ② | 0.5 | ||||
| ③ | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)形成离子键的阴、阳离子间只存在静电吸引力( )
(2)全部由非金属元素形成的化合物一定是共价化合物( )
(3)某些金属与非金属原子间能形成共价键( )
(4)某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键一定是离子键( )
(5)在水溶液中能导电的化合物一定是离子化合物( )
(6)离子化合物在任何状态下都能导电( )
(7)含有离子键的化合物中,一个阴离子可同时与几个阳离子形成静电作用( )
查看答案和解析>>
科目:高中化学 来源: 题型:
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是_________________________________________________________________
(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的________。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为________。取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是______________________________________________
_______________________________________________________________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是_______________________________________________________________。
(3)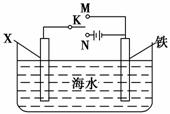 利用右图装置,可以模拟铁的电化学防护。
利用右图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应置于________处。若X为锌,开关K置于M处,该电化学防护法称为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com