
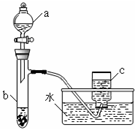
 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.分析 (1)①根据装置图可知仪器的名称;
②反应中N元素的化合价部分未变化生成硝酸铜,部分降低生成氮的氧化物;
③进入仪器c的气体为NO2,NO2与水反应生成NO;
④铜完全反应生成硝酸铜,向b中液体里加入足量氢氧化钠溶液,铜离子完全转化为氢氧化铜沉淀,根据n=$\frac{m}{M}$计算铜的物质的量,根据铜原子守恒计算氢氧化铜的物质的量,再根据m=nM计算;
(2)①利用极限法分析解答,全部为Fe3+时,溶液中NO3-的物质的量最大,全部为Fe2+时,溶液中NO3-的物质的量最小,据此解答;
②用a表示出溶液中Fe3+、Fe2+的物质的量,进而用a表示出溶液中NO3-的物质的量,根据氮原子守恒用a、b表示出NO的物质的量,根据电子转移守恒解答.
解答 解:(1)①根据装置图可知仪器a的名称是分液漏斗,
故答案为:分液漏斗;
②反应中N元素的化合价部分未变化生成硝酸铜,硝酸表现酸,性部分降低生成氮的氧化物,硝酸表现强氧化性,
故答案为:酸性和强氧化性;
③进入仪器c的气体为NO2,NO2与水反应生成NO,仪器c中收集的气体主要是NO,故答案为:NO;
④6.4g铜的物质的量为$\frac{6.4g}{64g/mol}$=0.1mol,向b中液体里加入足量氢氧化钠溶液,铜离子完全转化为氢氧化铜沉淀,根据铜原子守恒可知n[Cu(OH)2]=n(Cu)=0.1mol,故m[Cu(OH)2]=0.1mol×98g/mol=9.8g,
故答案为:9.8;
(2)①全部为Fe3+时,溶液中NO3-的物质的量最大,故NO3-的物质的量最大为3amol,全部为Fe2+时,溶液中NO3-的物质的量最小,故NO3-的物质的量最小为3amol,由于溶液中含有Fe3+和Fe2+,故2amol<n(NO3-)<3amol,
故答案为:2amol<n(NO3-)<3amol;
②n(Fe3+):n(Fe2+)=3:1,则n(Fe3+)=$\frac{3}{4}$amol、n(Fe2+)=$\frac{1}{4}$amol,故溶液中n(NO3-)=3n(Fe3+)+2n(Fe2+)=$\frac{3}{4}$amol×3+$\frac{1}{4}$amol×2=$\frac{11a}{4}$mol,由氮原子守恒可知,n(NO)=bmol-$\frac{11a}{4}$mol,根据电子转移守恒有:$\frac{3}{4}$amol×3+$\frac{1}{4}$amol×2=(b-$\frac{11a}{4}$)mol×(5-2),整理得b:a=$\frac{11}{3}$,
故答案为:$\frac{11}{3}$.
点评 本题考查硝酸的化学性质、化学计算等,难度中等,注意利用守恒思想与极限法的进行的计算.


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 有白色沉淀生成 | |
| B. | 有红棕色沉淀生成 | |
| C. | 没有沉淀生成 | |
| D. | 既有红褐色沉淀生成又有无色气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
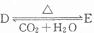 ,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E•xH2O的化学式为Na2C03•7H2O.
,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E•xH2O的化学式为Na2C03•7H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
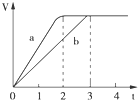 镁粉和铝粉分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,下列说法正确的是( )
镁粉和铝粉分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,下列说法正确的是( )| A. | 镁粉和铝粉的物质的量之比为3:2 | |
| B. | 镁粉和铝粉质量之比为3:2 | |
| C. | 镁粉和铝粉的摩尔质量之比为2:3 | |
| D. | 镁粉和铝粉反应完所需时间之比为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 可简写为
可简写为
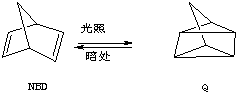
 ,系统命名为甲苯.
,系统命名为甲苯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
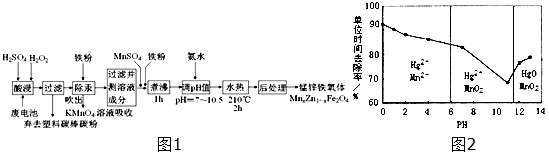
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
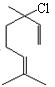 ;
;
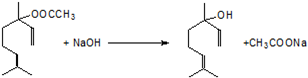 ,.
,.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com