
【题目】用NA表示阿伏伽德罗常数,下列叙述中正确的是( )
A.在标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为 ![]() NA
NA
B.1mol碳正离子CH5+所含的电子数为10NA
C.56g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA
D.0.5molC3H8分子中含C﹣H共价键2NA
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Cl﹣、SO42﹣、CO32﹣、NH4+、Fe3+、Fe2+和Na+ . 某同学为了确认其成分,取部分溶液,设计并完成了如图实验:下列说法正确的是( ) 
A.原溶液中c(Fe3+)=0.2molL﹣1
B.SO42﹣、NH4+、Na+一定存在,CO32﹣一定不存在
C.要确定原溶液中是否含有Fe2+ , 其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+
D.溶液中至少有4种离子存在,其中Cl﹣一定存在,且c(Cl﹣)≥0.2molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热条件下,将24.0gCuO和Fe2O3的混合物与足量的CO完全反应,并将反应后的气体全部通入到足量的澄清石灰水中,得到白色沉淀40.0g.下列有关叙述中不正确的是( )
A.原混合物中CuO和Fe2O3的物质的量的比为1:1
B.参加反应的CO的质量为11.2g
C.原混合物中Fe元素的质量为5.6g
D.原混合物中CuO的质量分数约为33.3%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现在有如下三个反应,有关判断正确的是( )
①Zn+2HCl ![]() ZnCl2+H2↑;②NaOH+HCl
ZnCl2+H2↑;②NaOH+HCl ![]() NaCl+H2O;
NaCl+H2O;
③2HCl ![]() H2↑+Cl2↑
H2↑+Cl2↑
选项 | 有关判断 |
A | 反应①是置换反应,HCl表现还原性 |
B | 反应②是复分解反应,HCl表现氧化性 |
C | 反应③中HCl既表现氧化性也表现还原性 |
D | 反应①中氢原子失去电子 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地壳中含量第一和第三的两元素形成的化合物不具有的性质是( )
A.熔点很高B.与铁在高温下发生放热反应
C.能溶于氢氧化钠溶液D.熔融后可以导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是( ) 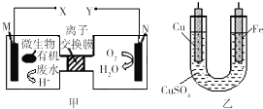
A.质子透过离子交换膜由右向左移动
B.铜电极应与X相连接
C.M电极反应式:(C6H10O5)n+7nH2O﹣24ne﹣═6nCO2↑+24nH+
D.当N电极消耗0.2 mol气体时,则铁电极增重16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知砒霜As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O
(1)请用“双线桥法”标出电子转移的方向和数目:。
(2)As2O3在上述反应中________。
A.被氧化
B.被还原
C.既被氧化又被还原
D.既未被氧化又未被还原
(3)该反应的氧化产物是 , 氧化剂是。
(4)若生成0.1 mol AsH3 , 则转移的电子数为。(用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据所学知识回答下列问题:
(1)已知常温时红磷比白磷稳定,比较下列反应中△H的大小:△H1△H2 .
①P4(白磷,s)+5O2(g)═2P2O5(s)△H1
②4P(红磷,s)+5O2(g)═2P2O5(s)△H2
(2)已知:稀溶液中,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJmol﹣1 , 则浓硫酸与稀氢氧化钠溶液反应生成1mol水,放出的热量57.3kJ.
(3)已知:C3H8(g )═CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJmol﹣1
CH3CH=CH2(g)═CH4(g)+HC≡CH(g)△H2=32.4kJmol﹣1
则相同条件下,反应C3H8(g)═CH3CH=CH2 (g)+H2(g)的△H=kJmol﹣1
(4)如图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和隔膜,该电池反应为2Na+xS=Na2Sx . 该电池正极的电极反应式为 .
用该电池作电源进行铁件镀铜时,若电镀池中两电极的质量开始相同,电镀完成后取出洗净、烘干、称量,二者质量差为25.6g,则理论上该电池负极消耗的质量为g.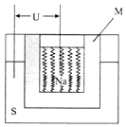
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氧化铁还原为铁的技术在人类文明的进步中占有十分重要的地位.炼铁高炉中发生的关键反应如下:
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
CO2(g)+C(s)═2CO(g)△H=+172.46kJ/mol
Fe2O3+CO→Fe+CO2
若已知:2Fe(s)+ ![]() O2(g)═Fe2O3(s)△H=﹣824.21kJ/mol
O2(g)═Fe2O3(s)△H=﹣824.21kJ/mol
根据上面三个热化学方程式,回答下列问题:
(1)CO的燃烧热为;写出其热化学方程式 .
(2)高炉内Fe2O3被CO还原为Fe的热化学方程式为 .
(3)炼制1t(吨)含铁96%的生铁所需焦炭的理论用量是t(结果保留两位有效数字),实际生产中所需焦炭远高于理论用量,其原因是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com