
已知工业冶炼铜时发生反应:2CuFeS2+O2![]() Cu2S+2FeS+SO2↑,其中CuFeS2中Fe元素是+2价。则下列说法正确的是
Cu2S+2FeS+SO2↑,其中CuFeS2中Fe元素是+2价。则下列说法正确的是
A.只有O2是氧化剂,CuFeS2是还原剂
B.每生成1mol SO2,则转移电子数为4mol
C.FeS既是氧化产物又是还原产物
D.SO2既是氧化产物又是还原产物
科目:高中化学 来源: 题型:阅读理解
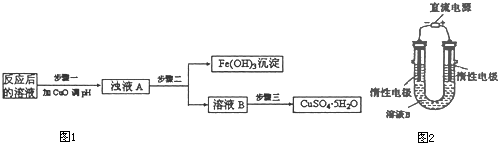
| Ksp | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.6×10-39 | 1.9 | 3.2 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
| ||
| ||
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省泉州市高三1月质量检查化学试卷(解析版) 题型:填空题
(9分)生产生活中广泛涉及氧化还原反应。
(1)工业上冶炼下列物质通常不采用电解法的是???????? 。
a.Na???????? b.Mg???????? c.Fe???????? d.Ag
(2)下图为电解精炼铜的示意图,电极a为粗铜,则a连接电源的 ????? 极,b极的电极反应式为?????????????????????? 。

(3)汽车剧烈碰撞时,安全气囊中发生反应NaN3 + KNO3 → K2O + Na2O + X↑(未配平),已知X为单质,在反应中NaN3失去电子。则该反应的氧化剂为??????????????? ,X的化学式为???????? ,该反应的氧化剂和还原剂的物质的量之比为?????????? 。
(4)工业上制取高纯度MnO2的某一步骤如图所示,请写出该反应的离子方程式?????????????????? 。

查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济南市高三下学期5月针对训练理综化学试卷(解析版) 题型:填空题
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H= -28.5 kJ·(mol-1
2Fe(s)+3CO2(g) △H= -28.5 kJ·(mol-1
(1)已知:C(石墨)+CO2 (g) 2CO(g) △H= + 172.5 kJ·mol-1
2CO(g) △H= + 172.5 kJ·mol-1
则反应:Fe2O3
(S) +3C(石墨) 2Fe(s)+3CO(g) △H= kJ·mol-1
2Fe(s)+3CO(g) △H= kJ·mol-1
(2)冶炼铁反应 Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H=-28.5 kJ·mol-1的平衡常数表达式K= ,温度降低后,K值
.(填“增大”、“不变”或“减小”)。
2Fe(s)+3CO2(g) △H=-28.5 kJ·mol-1的平衡常数表达式K= ,温度降低后,K值
.(填“增大”、“不变”或“减小”)。
(3)在ToC时,该反应的平衡常数K=27,在1L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
|
|
Fe2 O3 |
CO |
Fe |
CO2 |
|
甲容器 |
1.0 mol |
1.0 mol |
1.0 mol |
1.0 mol |
|
乙容器 |
1.0 mol |
2.0 mol |
1.0 mol |
1.0 mol |
①甲容器中CO的平衡转化率为
②下列说法正确的是 (填字母)。
a.乙容器中CO的平衡转化率小于甲容器
b.甲、乙容器中,CO2的平衡浓度之比为2:3
c.当容器内气体压强保持不变时,标志反应达到平衡状态
d.当容器中气体密度保持不变时,标志反应达到平衡状态
(4)钢铁工业是国家工业的基础,请回答钢铁腐蚀与防护过程中的有关问题。
①下列哪个装置可防止铁棒被腐蚀 (填编号)。

②在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图:A电极对应的金属是 (写元素名称),B电极的电极反应式是 。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
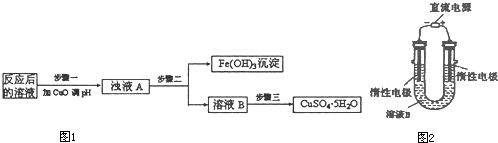
| Ksp | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.6×10-39 | 1.9 | 3.2 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
 O2(g)=Cu2O(s)△H=-12kJ?mol-1
O2(g)=Cu2O(s)△H=-12kJ?mol-1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com