
| A. | 位于第四周期、第ⅠA 族 | |
| B. | 氢氧化铷是弱碱 | |
| C. | 在钠、钾、铷3种单质中,铷的熔点最高 | |
| D. | 硝酸铷是离子化合物 |
分析 A.Rb位于第五周期;
B.元素的金属性越强,其相应碱的碱性越强;
C.在碱金属元素中,单质的熔点随着原子序数的增大而减小;
D.碱金属元素的硝酸盐是离子化合物.
解答 解:A.Rb位于第五周期第IA族,在K元素的下方,故A错误;
B.元素的金属性越强,其相应碱的碱性越强,Rb的金属性大于K,KOH是强碱,则RbOH也是强碱,故B错误;
C.碱金属元素中,单质的熔点随着原子序数的增大而减小,所以在钠、钾、铷中,铷的熔点最低,故C错误;
D.碱金属元素的硝酸盐是离子化合物,故D正确;
故选D.
点评 本题考查了碱金属元素的性质,明确元素周期律内涵是解本题关键,根据元素周期律知识来分析解答即可,以第IA族、第VIIA族为代表掌握金属族元素、非金属族元素性质及其递变规律,题目难度不大.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 溶液 | 离子组 |
| A | 滴加NaOH溶液可产生有刺激性气味的气体的溶液中 | K+、S2-、SO${\;}_{4}^{2-}$、NO3- |
| B | 有HCO${\;}_{3}^{-}$存在的溶液中 | Na+ K+、Cl-、AlO${\;}_{2}^{-}$ |
| C | pH=1的溶液中 | F-、Ca+、NO${\;}_{3}^{-}$、K+ |
| D | 能使紫色石蕊试液变红的溶液中 | Fe2+、MnO4-、NO${\;}_{3}^{-}$、SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | H | |||||||
| 2 | C | O | ||||||
| 3 | Na | Mg | Al | Si | S | |||
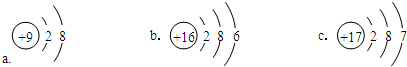
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素在自然界均不能以游离态存在 | |
| B. | X、Z、W均可形成两种常见氧化物 | |
| C. | 元素X、Y、W的最高化合价均与其族序数相等 | |
| D. | 离子半径:W>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可在金属与非金属交界处寻找半导体材料 | |
| B. | 农药中常含有的元素通常在元素周期表的右上方区域内 | |
| C. | 作催化剂材料的元素通常在元素周期表的左下方区域内 | |
| D. | 在过渡元素中可寻找耐高温和耐腐蚀的合金材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | |
| D |
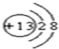
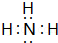 ,Y的结构式为
,Y的结构式为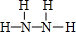
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
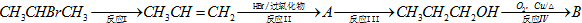 请回答下列问题:
请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com