
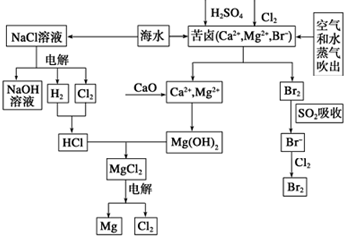
 海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料.下图是海水综合利用的部分流程图,据图回答问题:
海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料.下图是海水综合利用的部分流程图,据图回答问题:分析 (1)粗盐中的SO42-,用氯化钡除去,Mg2+加入过量NaOH除去;Ca2+加Na2CO3溶液,既可以除去溶液中的钙离子,还可以出去溶液中多余的钡离子;过滤后用盐酸除去过量的氢氧根离子、碳酸根离子,碳酸钠必须放在氯化钡溶液之后;
(2)①电解池中和电源的正极相连的是电解池的阳极,发生失电子的氧化反应;阳离子交换膜只允许阳离子通过,而阴离子不能通过;电解饱和食盐水的方法制备氯气,阳极,溶液中氯离子失电子发生氧化反应生成氯气,阴极,溶液中氢离子得到电子发生还原反应,生成氢气;
②氯化镁失水发生水解生成氢氧化镁沉淀,为防止水解应在氯化氢气流中加热脱水;
(3)溴有氧化性,二氧化硫有还原性,在水溶液里,二氧化硫和溴发生氧化还原反应;在自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性;
(4)吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出,生成溴化钠和溴酸钠,在酸溶液中会反应归中反应生成溴单质,溴单质在四氯化碳中溶解后分液通过蒸馏方法分离的溴单质.
解答 解:(1)除去粗盐中的可溶性杂质:SO42-、Mg2+、Ca2+,加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;可以加入过量NaOH(去除镁离子):Mg2++2OH-=Mg(OH)2↓,加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3↓,最后加适量盐酸,盐酸与过量NaOH溶液和过量Na2CO3溶液发生反应,离子方程式为:H++OH-═H2O,CO32-+2H+═H2O+CO2↑,从而除掉过量的OH-、CO32-;碳酸钠必须加在氯化钡之后,否则过量的钡离子无法除去,
故答案为:BaCl2、NaOH、Na2CO3、HCl;
(2)①阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电解电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯,电解饱和食盐水的方法制备氯气,阳极,溶液中氯离子失电子发生氧化反应生成氯气,2Cl--2e=Cl2↑,阴极,溶液中氢离子得到电子发生还原反应,生成氢气,2H++2e-═H2↑,总的化学方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH,
故答案为:阻止H2与Cl2发生反应甚至发生爆炸或阻止Cl2与生成的NaOH溶液反应而使烧碱产品不纯; 2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH;
②氯化镁在水中乙发生水解,为抑制水解,氯化镁晶体应在氯化氢气流中脱水,
故答案为:防止MgCl2水解;
(3)溴有氧化性,二氧化硫有还原性,在水溶液里,二氧化硫和溴发生氧化还原反应生成硫酸和氢溴酸,反应方程式为:Br2+SO2+2H2O=2HBr+H2SO4,离子反应为:Br2+SO2+2H2O=2Br-+4H++SO42-,在自发进行的氧化还原反应中,还原剂的还原性大于还原产物的还原性,氧化剂氧化性大于氧化产物,Cl2+2Br-=Br2+2Cl-中还原性 Br->Cl-,SO2+2H2O+Br2=H2SO4+2HBr中还原性SO2>Br-,所以还原性强弱顺序是 SO2>Br->Cl-,则氧化性强弱顺序为:Cl2>Br2>SO2,
故答案为:Br2+SO2+2H2O=2Br-+4H++SO42-;Cl2>Br2>SO2;
(4)吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出,反应的离子方程式为:3Br2+3CO32-═5Br-+BrO-3+3CO2↑,生成溴化钠和溴酸钠,最后再用H2SO4处理得到Br2,说明溴离子和溴酸根离子在酸溶液中发生氧化还原反应生成溴单质,反应的离子方程式为:5Br-+BrO3-+6H+=3Br2+3H2O,加入CCl4进行Br2的萃取最后通过蒸馏操作分离得到溴单质,
故答案为:3Br2+3CO32-═5Br-+BrO-3+3CO2↑;蒸馏.
点评 本题考查海水的综合利用,侧重考查了离子性质的应用,混合物除杂的实验方案分析,氧化还原反应的强弱规律应用,离子方程式的书写方法,注意把握题给信息,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | S$\stackrel{O_{2}、点燃}{→}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | H2SO4$\stackrel{Cu}{→}$SO2$\stackrel{BaCl_{2}溶液}{→}$BaSO3 | |
| C. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{蒸发}{→}$无水FeCl3 | |
| D. | SiO2$\stackrel{NaOH}{→}$Na2SiO3$\stackrel{HCl}{→}$H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .若此烷烃的一氯代物分子中含有两个-CH3,两个-CH2-,一个
.若此烷烃的一氯代物分子中含有两个-CH3,两个-CH2-,一个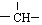 和一个-Cl,它的可能结构有四种,请写出它们的结构简式:CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3、CH3CH(CH3)CH2CH2Cl、CH2ClCH(CH3)CH2CH3.
和一个-Cl,它的可能结构有四种,请写出它们的结构简式:CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3、CH3CH(CH3)CH2CH2Cl、CH2ClCH(CH3)CH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验现象或事实 | 解释 |
| A | 检验待测溶液中SO42-,先滴入稀盐酸,再滴入BaCl2溶液 | 先滴入盐酸可排除Ag+、CO3-、SO32-等离子干扰 |
| B | 铝箔插入稀硝酸中 | 铝箔表面被HNO3氧化形成致密的氧化膜 |
| C | 向Fe(NO3)2溶液中加入稀硫酸,试管口有红棕色气体产生 | 溶液中NO3-被Fe2+还原为NO2 |
| D | 含Mg(HCO3)2的硬水长时间充分加热,最终得到的沉淀物的主要成分为Mg(OH)2而不是MgCO3 | Kap(MgCO3)<Kap[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一个甲醛分子由1个碳原子、2个氢原子、1个氧原子构成的 | |
| B. | 甲醛中碳、氢、氧三种元素的质量比为1:2:1 | |
| C. | 甲醛由碳、氢、氧三种元素组成的 | |
| D. | 甲醛中氧元素的质量分数为53.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
| A. | Na2SO3溶液中c(H+)<c (OH-) | |
| B. | Na2SO3溶液中c(Na+))>c (SO32-)>c (HSO3-)>c (OH-)>c(H+) | |
| C. | 当吸收液呈中性时,c(Na+))>c (SO32-)>c (HSO3-)>c (OH-)=c(H+) | |
| D. | 当吸收液呈中性时,c(Na+)>c (HSO3-)+c (SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | a | b | c |
| 样品质量(g) | 9.6 | 12.8 | 64.0 |
| 气体体积(L) | 5.04 | 6.72 | V |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 碳酸钠水解的离子方程式:CO32-+2H2O?OH-+H2CO3 | |
| C. | CH3COOH的电离方程式为:CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 次氯酸的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去混在Cu粉中的少量Mg粉和Al粉,加稀盐酸后过滤 | |
| B. | 分离汽油和煤油,可用萃取的方法 | |
| C. | 分离硝酸钾和氯化钠固体的混合物,可用溶解、过滤的方法 | |
| D. | 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com