
| A. | 铁螺丝连接锌板时,铁不容易生锈 | |
| B. | 反应CaC03(s)=Ca0(s)+C02(g)在常温下不能发生,则该反应的△H<0 | |
| C. | pH=11的NaOH溶液与pH=3的CH3COOH溶液混合后所得溶液pH小于7 | |
| D. | 电解精炼铜时,每转移1mol电子阳极上溶解的铜原子数小于0.5×6.02×1023 |
分析 A.作原电池正极的金属能防止被腐蚀;
B.依据反应自发想的判断依据是△H-T△S<0,结合反应特征分析;
C.醋酸为弱酸,醋酸溶液中存在电离平衡CH3COOH?H++CH3COO-,则pH=3的CH3COOH溶液,c(H+)=0.001mol/L,c(CH3COOH)>0.001mol/L;
D.电解时,比铜活泼的金属先溶解.
解答 解:A.铁螺丝连接锌板时,构成的原电池中Zn比Fe易失电子,所以Fe作正极而被保护,铁不容易生锈,故A正确;
B.CaCO3(s)高温分解为CaO(s)和CO2(g),反应方程式为:CaCO3(s)=CaO(s)+CO2(g),反应生成气体,是熵值增加的过程,则△S>0,室温下不能自发进行,△H-T△S>0,反应的熵变△S>0,则△H>0,故B错误;
C.pH值为3的CH3COOH和pH为11的NaOH溶液,两溶液中c(OH-)和c(H+)相等,但醋酸为弱酸,不能完全电离,所以醋酸浓度大,反应后酸过量,则混合溶液呈酸性,但呈酸性,不一定pH小于7,因反应的温度未知,故C错误;
D.电解法精炼铜时,粗铜作阳极,发生的反应有:Zn-2e-=Zn2+,Fe-2e-=Fe2+,Ni-2e-=Ni2+,Cu-2e-=Cu2+,可见每转移1mol电子时阳极上溶解的铜必小于0.5 NA,即小于0.5×6.02×1023,故D正确;
故选AD.
点评 本题考查较为综合,涉及金属的腐蚀与防腐、反应进行的方向、溶液的酸碱性、电解精炼铜等知识,掌握基础是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定有甲烷 | B. | 混合气体可能是甲烷和乙烯 | ||
| C. | 混合气体中一定有乙烷 | D. | 混合气体可能是乙烯和乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
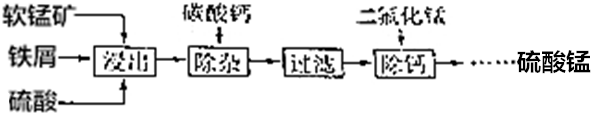
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
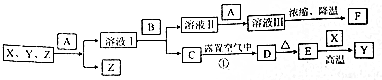
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||
| ⑨ | ⑩ |
 ;
;| 晶体Ⅰ | 晶体Ⅱ | |
| 熔点/K | 1840 | 2803 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
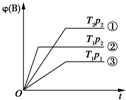 已知某可逆反应mA(g)+nB(g)?pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是( )
已知某可逆反应mA(g)+nB(g)?pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是( )| A. | T1<T2,p1>p2,m+n>p,放热反应 | B. | T1>T2,p1<p2,m+n>p,吸热反应 | ||
| C. | T1<T2,p1>p2,m+n<p,放热反应 | D. | T1>T2,p1<p2,m+n<p,吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com