


科目:高中化学 来源: 题型:
| A、盐酸 | B、过氧化钠 |
| C、双氧水 | D、氯化钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阴极、阳极所得到的产物质量比为1:8 |
| B、通电过程中阳离子向阳极移动 |
| C、阴极电极反应式为:Ag++e-=Ag |
| D、电解过程中溶液pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素铯的两种核素137Cs比133Cs多4个质子 |
| B、P、S、C1得电子能力和最高价氧化物对应水化物的酸性均依次增强 |
| C、元素原子的最外层电子数越多,越容易得电子 |
| D、从上到下,第VIIA族元素氢化物的热稳定性和还原性均依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
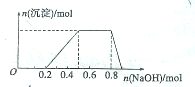
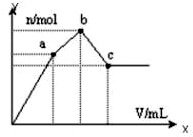 向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示.则下列说法中正确的是( )
向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示.则下列说法中正确的是( )| A、c点溶液呈碱性 |
| B、b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ |
| C、c点加入Ba(OH)2溶液的体积为200 mL |
| D、a点的溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2组 | B、3组 | C、4组 | D、5组 |
查看答案和解析>>
科目:高中化学 来源: 题型:
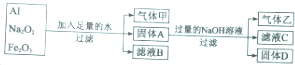
查看答案和解析>>
科目:高中化学 来源: 题型:
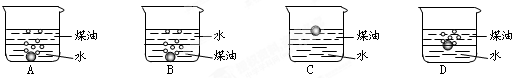
查看答案和解析>>
科目:高中化学 来源: 题型:
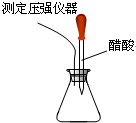 回答下列问题:
回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com