
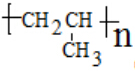 ��
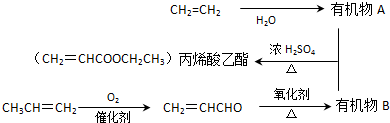
�� ���� CH2=CH2��ˮ�����ӳɷ�Ӧ������AΪCH3CH2OH��CH2=CHCHO����������Ӧ����BΪCH2=CHCOOH��CH2=CHCOOH��CH3CH2OH����������Ӧ���ɱ�ϩ�����������ݹ����ŵ����ʺͱ仯�жϷ�Ӧ���Ͳ�д����Ӧ�Ļ�ѧ����ʽ��
��� �⣺CH2=CH2��ˮ�����ӳɷ�Ӧ������AΪCH3CH2OH��CH2=CHCHO����������Ӧ����BΪCH2=CHCOOH��CH2=CHCOOH��CH3CH2OH����������Ӧ���ɱ�ϩ��������
��1����ϩȩ��CH2=CHCHO���к��еĹ�������̼̼˫����ȩ�����ʴ�Ϊ��̼̼˫����ȩ����
��2��CH2=CHCOOH��CH3CH2OH����������Ӧ���ɱ�ϩ��������ҲΪȡ����Ӧ����Ӧ�ķ���ʽΪCH2=CHCOOH+CH3CH2OH$?_{��}^{Ũ����}$CH2=CHCOOCH2CH3+H2O��
�ʴ�Ϊ��CH2=CHCOOH+CH3CH2OH$?_{��}^{Ũ����}$CH2=CHCOOCH2CH3+H2O��
��3��CH2=CHCH3����C=C���ɷ����Ӿ۷�Ӧ����Ӧ�ķ���ʽΪnCH2=CHCH3$\stackrel{������}{��}$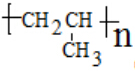 ��
��
�ʴ�Ϊ��nCH2=CHCH3$\stackrel{������}{��}$ ��
��
���� ���⿼���л���ĺϳɣ���Ŀ�ѶȲ�����ע����ճ����л���Ĺ����ŵ����ʣ���ס��Ӧ�����������л��ﷴӦ�Ļ�ѧ����ʽҪ��д��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 11��16 | B�� | 6��8 | C�� | 12��17 | D�� | 20��9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
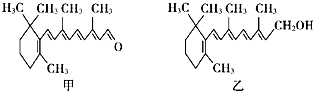
| A�� | �ӻ�ȩ�ķ���ʽΪC21H26O | |
| B�� | ά����A���ӽṹ�к��б�����̼̼˫�����ǻ� | |
| C�� | �ӻ�ȩ��ά����A���������� | |
| D�� | 1 mol��1 mol����һ�������¾��������6 mol H2������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
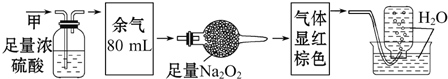
| A�� | NH3��NO2��N2 | B�� | NH3��NO��CO2 | C�� | NH3��NO2��CO2 | D�� | NO��CO2��N2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3Cl | B�� | 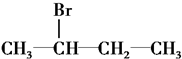 | ||
| C�� | 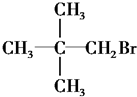 | D�� | 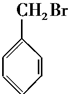 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ձ����У��������͵�أ�������ӦʽΪ2Al-6e-=2Al3+��������ӦʽΪ 6H++6e-=3H2�� | |
| B�� | �ձ����У������������Һ����Ũ���ᣬ�����͵��ʱ��Ϊ������ͭΪ���� | |
| C�� | �ձ����У�������ͭ�����͵�أ�����Ϊ�������������������͵�أ�����Ϊ���� | |
| D�� | �ձ����У�����������ȫ�ܽ⣬��Һ����ɫ������Һ�еμ�KSCN��Һ����Һ����ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
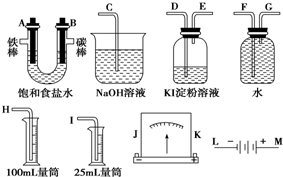
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com