
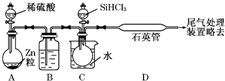
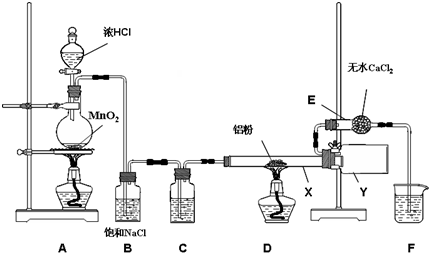
 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:分析 (1)高温下,碳和二氧化硅反应生成硅和一氧化碳;
(2)根据题中数据,采用分馏方法提纯SiHCl3;
(3)稀硫酸与锌反应生成氢气,在B中用浓硫酸干燥,C中加入条件下SiHCl3与过量H2反应制备纯硅,
①生成的氢气含有水蒸气,用浓H2SO4干燥;加热促使SiHCl3气化;
②SiHCl3和氢气反应有硅单质生成,根据硅的颜色判断D装置中的颜色变化;反应温度较高,普通玻璃会软化;SiHCl3和H2反应生成硅和氯化氢;
③氢气是可燃性气体,易产生爆炸,为防止安全事故的发生,所以先通一段时间H2,将装置中的空气排尽;
④取少量产品于试管中加盐酸溶解,再滴加氯水和KSCN(aq),若出现红色说明含Fe,若不出现红色说明不含Fe.
解答 解:(1)高温下,碳和二氧化硅反应生成硅和一氧化碳,反应方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(2)SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),由于沸点差别较大,可以通过分馏除去杂质,
故答案为:分馏;
(3)①锌和稀硫酸的反应是放热反应,所以生成的氢气含有水蒸气,为干燥氢气,一般选用浓H2SO4干燥;气体的反应速率较大,所以加热的目的是使SiHCl3气化,
故答案为:浓硫酸;使滴入烧瓶中的SiHCl3气化;
②高温下,SiHCl3和氢气反应生成硅单质,硅单质是灰黑色固体,所以D装置中的现象是:石英管的内壁附有灰黑色晶体;由于高温下,普通玻璃会软化,所以使用石英玻璃;反应方程式为:SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl,
故答案为:石英管的内壁附有灰黑色晶体;高温下,普通玻璃会软化;SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl;
③氢气是可燃性气体,当氢气的量达到一定时易产生爆炸,为防止安全事故的发生,所以先通一段时间H2,将装置中的空气排尽,
故答案为:先通一段时间H2,将装置中的空气排尽;
④铁能和酸反应生成亚铁离子,亚铁离子有还原性,亚铁离子能被氯水氧化生成铁离子,铁离子遇硫氰化钾溶液变红色,所以可以用氯水和硫氰化钾溶液检验铁的存在,
故选bd.
点评 本题考查了实验方案设计的有关知识,为高考常见题型,铁离子和亚铁离子的检验在高考题中出现,这种类型的题是高考的热点,是学习的重点,会根据实验目的和物质的性质选取实验装置和实验药品,然后进行相应的实验.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:多选题
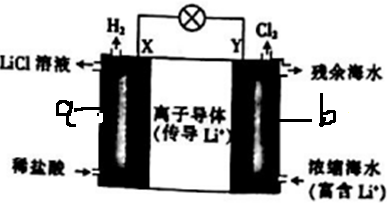
| A. | 电池工作时,Li+通过离子导体移向b区 | |
| B. | 电流由X极通过电路移向Y极 | |
| C. | 正极发生的反应为2H++2e-═H2↑ | |
| D. | Y极每生成1molCl2,a区得到2molLiCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,砷属于p区元素.
,砷属于p区元素.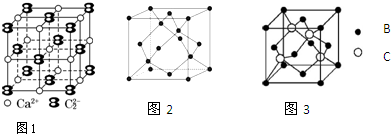
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 2AlCl3
2AlCl3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{48}^{112}$Cd原子的中子数为64 | |
| B. | 聚氯化铝能降污是因为它有强氧化性 | |
| C. | 聚氯化铝是混合物 | |
| D. | 镉的单质有导电性和延展性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com