
��ҵ������Ĺ��������÷�Ӧ2SO2��g����O2��g�� 2SO3��g������H<0����SO2ת��ΪSO3��β��SO2����NaOH��Һ������������ش��������⣺
2SO3��g������H<0����SO2ת��ΪSO3��β��SO2����NaOH��Һ������������ش��������⣺
��1��һ�������£���һ���������ܱ������г���2 mol SO2��1mol O2������Ӧ��������˵����ȷ����??????????????????? ��
A������Ӧ����v (SO2) ��v (SO3)�������˵���ÿ��淴Ӧ�Ѵﵽƽ��״̬
B�������¶Ⱥ������������������2 mol N2����ѧ��Ӧ���ʼӿ�
C��ƽ���������Ӧ��Ũ�ȣ���ƽ��һ�����ƣ�����Ӧ���ת����һ��������
D��ƽ����ƶ�����ѹ�����壬ƽ��ʱSO2��O2�İٷֺ�����С��SO3���ٷֺ�������
E��ƽ��������¶ȣ�ƽ�ⳣ��K����
F�������¶Ⱥ��������������ƽ���������2molSO3���ٴ�ƽ��ʱ�����Ũ�Ⱦ���ԭƽ��ʱ��Ũ�ȴ�
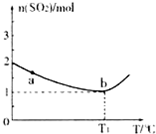
��2����һ������SO2��g����O2��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У��ڲ�ͬ�¶��½��з�Ӧ�õ����±��е��������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
SO2 | O2 | SO2 | O2 | |||
1 | T1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | 4 | 2 | 0.4 | y | 9 |
��ʵ��1�ӿ�ʼ����Ӧ�ﵽ��ѧƽ��ʱ��v��SO2����ʾ�ķ�Ӧ����Ϊ??????? ��? ����y? ��?????? ��
��T1????????????????? T2 ,(ѡ����>������<������=��), ʵ��2�д�ƽ��ʱ O2��ת����Ϊ???????????????? ��
��3��β��SO2��NaOH��Һ���պ������Na2SO3�����г�����0.1 mol/L Na2SO3��Һ��ʵ��ⶨ��pHԼΪ8������������⣺
�� ����Һ��c(Na+)�� c(OH��) ֮��Ϊ???????????????????????????????????????? ��
�� ����Һ��c(OH-) = c(H+)+ ???????????? + ????????????? ������Һ����������Ũ�ȱ�ʾ����
�� �������Һ�м�������NaOH����ʱ��c(SO32��)???????????????? , ˮ�����ӻ�Kw? ??? ??????????????? ����ѡ����������������С��������������
��4������ú������ʵ������ʵ����и���Һ�ֱ�������SO2���������������ɶൽ�ٵ�˳���� ????????????????????????????????????????????? ��
A�� Na2CO3???????? ?? B�� Ba(NO3)2 ??????????? C��Na2S???????? D������KMnO4
��1��D F����2����? 0.2 mol�� L-1�� min-1��??? 0.2 mol???? ��? >��?? 90��
��3���� 2��105 ��??? �� c(HSO3-)+2c(H2SO3)?? �� ������ ����? ��4��B��C = D��A??? ��
��������
�����������1��A��û����ȷv����v������Ӧ����v (SO2) ��v (SO3)������˵���ÿ��淴Ӧ�Ѵﵽƽ��״̬������B�������¶Ⱥ������������������2 mol N2��SO2��SO3��O2Ũ�Ȳ��䣬��ѧ��Ӧ���ʲ��䣬����C��ƽ���������Ӧ��Ũ�ȣ���ƽ��һ�����ƣ�������Ӧ���ת���ʲ�һ����������D���÷�Ӧ����Ϊ���������С�ķ�Ӧ��ƽ����ƶ�����ѹ�����壬ƽ�������ƶ���ƽ��ʱSO2��O2�İٷֺ�����С��SO3���ٷֺ���������ȷ��E���÷�ӦΪ���ȷ�Ӧ��ƽ��������¶ȣ�ƽ�������ƶ���ƽ�ⳣ��K��С������F�������¶Ⱥ��������������ƽ���������2molSO3��ƽ�������ƶ����ٴ�ƽ��ʱ�����Ũ�Ⱦ���ԭƽ��ʱ��Ũ�ȴ���ȷ��ѡDF����2��������������ݷ�����ʵ��1�ӿ�ʼ����Ӧ�ﵽ��ѧƽ��ʱO2�����ʵ����仯Ϊ1.2mol�����ݷ�Ӧ����ʽȷ��SO2�����ʵ����仯Ϊ2.4mol�����ݹ�ʽv=��n/��tV���㣬v��SO2����ʾ�ķ�Ӧ����Ϊ0.2 mol�� L-1�� min-1������������ݷ�����ʵ��2�ӿ�ʼ����Ӧ�ﵽ��ѧƽ��ʱSO2�����ʵ����仯Ϊ3.6mol�����ݷ�Ӧ����ʽȷ��O2�����ʵ����仯Ϊ1.8mol����ƽ��ʱO2�����ʵ���Ϊ0.2mol������y��0.2mol��������������ݷ������¶���T1��ΪT2,ƽ�������ƶ����÷�ӦΪ���ȷ�Ӧ�������¶ȶԻ�ѧƽ���Ӱ������жϣ��ı������Ϊ���£���T1>T2 , ����������ݷ�����ʵ��2�ӿ�ʼ����Ӧ�ﵽ��ѧƽ��ʱSO2�����ʵ����仯Ϊ3.6mol�����ݷ�Ӧ����ʽȷ��O2�����ʵ����仯Ϊ1.8mol����ʵ��2�д�ƽ��ʱ O2��ת����Ϊ90������3����������0.1 mol/L Na2SO3��Һ��c(Na+)=0.2mol/L��ʵ��ⶨ��pHԼΪ8��c(OH��)=10��6 mol/L������Һ��c(Na+)�� c(OH��) ֮��Ϊ2��105���� ���������غ㣬����Һ��c(OH-) = c(H+)+c(HSO3-)+2c(H2SO3) ���� ������0.1 mol/L Na2SO3��Һ����ˮ��ƽ�⣺SO32- + H2O  HSO3- + OH-,�������Һ�м�������NaOH����ʱ��������Ũ������ƽ�������ƶ���c(SO32��)�����¶Ȳ��䣬ˮ�����ӻ�Kw ���䣻��4������������ʵ���Ϊ1mol��A�����ݻ�ѧ����ʽ2SO2+Na2CO3+H2O=2NaHSO3 +CO2 �жϣ�1molNa2CO3�������2molSO2��B�� ���ݻ�ѧ����ʽBa(NO3)2 +3SO2 +2H2O=BaSO4+2H2SO 4 �жϣ�1molBa(NO3)2 �������3molSO2��C�����ݻ�ѧ����ʽ2Na2S +SO2 +2H2O=3S+4NaOH��SO2 +NaOH=NaHSO3�жϣ�1molNa2S�������2.5molSO2��D�����ݵ����غ��жϣ�1molKMnO4�������2.5molSO2���������������ɶൽ�ٵ�˳����B��C = D��A ��
HSO3- + OH-,�������Һ�м�������NaOH����ʱ��������Ũ������ƽ�������ƶ���c(SO32��)�����¶Ȳ��䣬ˮ�����ӻ�Kw ���䣻��4������������ʵ���Ϊ1mol��A�����ݻ�ѧ����ʽ2SO2+Na2CO3+H2O=2NaHSO3 +CO2 �жϣ�1molNa2CO3�������2molSO2��B�� ���ݻ�ѧ����ʽBa(NO3)2 +3SO2 +2H2O=BaSO4+2H2SO 4 �жϣ�1molBa(NO3)2 �������3molSO2��C�����ݻ�ѧ����ʽ2Na2S +SO2 +2H2O=3S+4NaOH��SO2 +NaOH=NaHSO3�жϣ�1molNa2S�������2.5molSO2��D�����ݵ����غ��жϣ�1molKMnO4�������2.5molSO2���������������ɶൽ�ٵ�˳����B��C = D��A ��
���㣺���黯ѧ��Ӧ���ʺͻ�ѧƽ�⡢�������Һ�����ݻ�ѧ����ʽ���㡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �о���ѧ��Ӧԭ�����������������������������Ҫ���壮
�о���ѧ��Ӧԭ�����������������������������Ҫ���壮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ������ʡ�����и����ʼ죨һ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
��ҵ������Ĺ��������÷�Ӧ2SO2��g����O2��g�� 2SO3��g������H��0����SO2ת��ΪSO3��β��SO2����NaOH��Һ������������ش��������⣺
2SO3��g������H��0����SO2ת��ΪSO3��β��SO2����NaOH��Һ������������ش��������⣺
��1��һ�������£���һ���������ܱ������г���2molSO2��1molO2������Ӧ��������˵����ȷ����???????????? ��
A������Ӧ����v(SO2)=v(SO3)�������˵���ÿ��淴Ӧ�Ѵﵽƽ��״̬
B�������¶Ⱥ������������������2 mol N2����ѧ��Ӧ���ʼӿ�
C��ƽ���������Ӧ��Ũ�ȣ���ƽ��һ�����ƣ�����Ӧ���ת����һ��������
D��ƽ����ƶ�����ѹ�����壬ƽ��ʱSO2��O2�İٷֺ�����С��SO3���ٷֺ�������
E�������¶Ⱥ��������������ƽ���������2molSO3���ٴ�ƽ��ʱ�����Ũ�Ⱦ���ԭƽ��ʱ��Ũ�ȴ�
F��ƽ��������¶ȣ�ƽ�ⳣ��K����
��2����һ������SO2��g����O2��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У��ڲ�ͬ�¶��½��з�Ӧ�õ����±��е��������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
SO2 | O2 | SO2 | O2 | |||
1 | T1 | 4 | 2 | x | 0��8 | 6 |
2 | T2 | 4 | 2 | 0��4 | y | 9 |
��ʵ��1�ӿ�ʼ����Ӧ�ﵽ��ѧƽ��ʱ��v��SO2����ʾ�ķ�Ӧ����Ϊ????? ������y=???? ��
��T1?? ??? T2 ,(ѡ��������������������=��),ʵ��2�д�ƽ��ʱ O2��ת����Ϊ??????? ��
��3��β��SO2��NaOH��Һ���պ������Na2SO3�����г�����0��1mol/LNa2SO3��Һ��ʵ��ⶨ��pHԼΪ8������������⣺
������Һ��c��Na+���� c��OH-�� ֮��Ϊ?????????? ��
������Һ��c��OH-�� = c��H+��+ ??????? + ??????? ������Һ����������Ũ�ȱ�ʾ����
���������Һ�м�������NaOH����ʱ��c��SO32-��???? ,c��Na+��???? ����ѡ����������������С��������������
��4������ú������ʵ������ʵ����и���Һ�ֱ�������SO2���������������ɶൽ�ٵ�˳���� ??????????? ��
A��Na2CO3?? ???? B��Ba(NO3)2 ??? C��Na2S??? D������KMnO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�걱���к�����������ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
���Ṥ���������к���SO2���ж��ַ�����ʵ����������
��1����ҵ������Ĺ����У�SO2�����������Ļ�ѧ����ʽΪ ��
��2����ʪʽ���շ����������ռ���SO2������Ӧ�Ӷ�����
��֪��25��ʱ��H2SO3
 HSO3 -+H+
K=1.5��10-2
HSO3 -+H+
K=1.5��10-2
H2CO3 HCO3 -+H+ K=4.4��10-7
HCO3 -+H+ K=4.4��10-7
�����Լ����ʺ������÷����ռ����� ������ĸ��ţ���
a.ʯ���� b. Na2SO3��Һ c. Na2CO3��Һ
�ڡ��Ƽ����NaOH��Һ�����ռ�����100 mL 0.2 mol��L-1 ��NaOH��Һ��ͨ���״����0.448 L SO2���壬��Ӧ������ҺpH<7������Һ�����и�����Ũ�ȹ�ϵ��ȷ���� ������ĸ��ţ���
a.c(HSO3-)> c(SO32-)> c(H2SO3)
b.c(Na+)>c(HSO3-)> c(H+)> c(SO32-)
c.c(Na+)+c(H+)= c(HSO3-)+c(SO32-)+c(OH-)
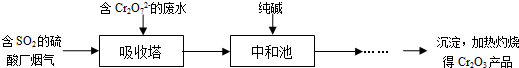
��3��ij���᳧��������������Cr2O72-�����Է�ˮ���������ͬʱ�Ʊ�Cr2O3��Ʒ�������������£�

���������з�Ӧ��ĸ�Ԫ����Cr3+��ʽ���ڣ������з�����Ӧ�����ӷ���ʽΪ ��
���кͳ��еķ�Ӧ������Cr(OH)3�����⣬�������ij�����壬������Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com