
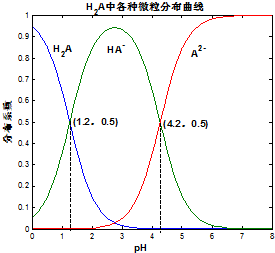
 ³£ĪĀĻĀ 0.1mol/LµÄH2AČÜŅŗÖŠH2A”¢HA-”¢A2- ČżÕßÖŠĖłÕ¼ĪļÖŹµÄĮæ·ÖŹż£Ø·Ö²¼ĻµŹż£©ĖępH±ä»ÆµÄ¹ŲĻµČēĶ¼ĖłŹ¾£®ĻĀĮŠ±ķŹö²»ÕżČ·µÄŹĒ£Ø””””£©
³£ĪĀĻĀ 0.1mol/LµÄH2AČÜŅŗÖŠH2A”¢HA-”¢A2- ČżÕßÖŠĖłÕ¼ĪļÖŹµÄĮæ·ÖŹż£Ø·Ö²¼ĻµŹż£©ĖępH±ä»ÆµÄ¹ŲĻµČēĶ¼ĖłŹ¾£®ĻĀĮŠ±ķŹö²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | H2A?2H++A2- K=10-5.4 | |
| B£® | ŌŚ 0.1mol/L NaHAČÜŅŗÖŠ£¬ø÷Ąė×ÓÅØ¶Č“óŠ”¹ŲĻµĪŖ£ŗc£ØNa+£©£¾c£ØHA-£©£¾c£ØH+£©£¾c£ØA2-£©£¾c£ØOH-£© | |
| C£® | ŅŃÖŖ25”ꏱHFµÄ Ka=10-3.45£¬½«ÉŁĮæH2AµÄČÜŅŗ¼ÓČė×ćĮæNaFČÜŅŗÖŠ£¬·¢ÉśµÄ·“Ó¦ĪŖ£ŗH2A+F-ØTHF+HA- | |
| D£® | ½«µČĪļÖŹµÄĮæµÄNaHA”¢Na2AČÜÓŚĖ®ÖŠ£¬ĖłµĆČÜŅŗpHĒ”ŗĆĪŖ4.2 |
·ÖĪö ÓÉĶ¼ĻóæÉÖŖ£¬pH=1.2Ź±£¬ČÜŅŗÖŠ“ęŌŚH2A”¢HA-£¬ĒŅ¶žÕßÅضČĻąµČ£¬ĖµĆ÷H2A²æ·ÖµēĄė£¬µēĄė·½³ĢŹ½ĪŖH2A?H++HA-£¬ŌņK1=$\frac{c£Ø{H}^{+}£©”Įc£ØH{A}^{-}£©}{c£Ø{H}_{2}A£©}$=10-1.2£¬
pH=4.2Ź±£¬HA-”¢A2-ÅضČĻąµČ£¬ĒŅ¶žÕßÅضČĻąµČ£¬µēĄė·½³ĢŹ½ĪŖHA-?H++A2-£¬ŌņK2=$\frac{c£Ø{H}^{+}£©”Įc£Ø{A}^{2-}£©}{c£ØH{A}^{-}£©}$=10-4.2£¬ŅŌ“Ė½ā“šøĆĢā£®
½ā“š ½ā£ŗÓÉĶ¼ĻóæÉÖŖ£¬pH=1.2Ź±£¬ČÜŅŗÖŠ“ęŌŚH2A”¢HA-£¬ĒŅ¶žÕßÅضČĻąµČ£¬ĖµĆ÷H2A²æ·ÖµēĄė£¬µēĄė·½³ĢŹ½ĪŖH2A?H++HA-£¬ŌņK1=$\frac{c£Ø{H}^{+}£©”Įc£ØH{A}^{-}£©}{c£Ø{H}_{2}A£©}$=10-1.2£¬
pH=4.2Ź±£¬HA-”¢A2-ÅضČĻąµČ£¬ĒŅ¶žÕßÅضČĻąµČ£¬µēĄė·½³ĢŹ½ĪŖHA-?H++A2-£¬ŌņK2=$\frac{c£Ø{H}^{+}£©”Įc£Ø{A}^{2-}£©}{c£ØH{A}^{-}£©}$=10-4.2£¬
A£®H2A²æ·ÖµēĄė£¬·Ö²½µēĄė£¬ŅŌµŚŅ»²½µēĄėĪŖÖ÷£¬ŌņµēĄė·½³ĢŹ½ĪŖH2A?H++HA-£¬¹ŹA“ķĪó£»
B£®pH=4.2Ź±£¬HA-”¢A2-ÅضČĻąµČ£¬ČÜŅŗ³ŹĖįŠŌ£¬ĖµĆ÷HA-µēĄė³Ģ¶Č“óÓŚHA-Ė®½ā³Ģ¶Č£¬ŌņŌŚ0.1mo/LNaHAČÜŅŗÖŠ£¬ø÷Ąė×ÓÅØ¶Č“óŠ”¹ŲĻµĪŖ£ŗc£ØNa+£©£¾c£ØHA-£©£¾c£ØH+£©£¬Ņņ»¹“ęŌŚĖ®µÄµēĄė£¬Ōņc£ØH+£©£¾c£ØA2-£©£¾c£ØOH-£©£¬ĖłŅŌø÷Ąė×ÓÅØ¶Č“óŠ”¹ŲĻµĪŖ£ŗc£ØNa+£©£¾c£ØHA-£©£¾c£ØH+£©£¾c£ØA2-£©£¾c£ØOH-£©£¬¹ŹBÕżČ·£»
C£®ŅŃÖŖ25”ꏱHFµÄKa=10-3.45£¬ÓÉŅŌÉĻŠÅĻ¢æÉÖŖK1=$\frac{c£Ø{H}^{+}£©”Įc£ØH{A}^{-}£©}{c£Ø{H}_{2}A£©}$=10-1.2£¬K2=$\frac{c£Ø{H}^{+}£©”Įc£Ø{A}^{2-}£©}{c£ØH{A}^{-}£©}$=10-4.2£¬ŌņĖįŠŌH2A£¾HF£¾HA-£¬Ōņ½«ÉŁĮæH2AµÄČÜŅŗ¼ÓČė×ćĮæµÄNaFČÜŅŗÖŠ£¬·¢ÉśµÄ·“Ó¦ĪŖ£ŗH2A+F-ØTHF+HA-£¬¹ŹCÕżČ·£»
D£®HA-¼“ÄÜĖ®½āÓÖÄܵēĄė£¬A2-ÄÜĖ®½ā£¬¶ųĒŅA2-µÄĖ®½ā³Ģ¶Č“óÓŚHA-µÄĖ®½ā³Ģ¶Č£¬¹Ź½«ĻąĶ¬ĪļÖŹµÄĮæµÄNaHAŗĶNa2A¹ĢĢåČÜÓŚĖ®ŗó£¬HA-ŗĶA2-µÄÅØ¶Č²»ŌŁĻąµČ£¬ĪŽ·Ø¼ĘĖćČÜŅŗµÄpH£¬¹ŹD“ķĪó£®
¹ŹŃ”AD£®
µćĘĄ ±¾Ģāæ¼²éĮĖĄė×ÓÅØ¶Č“óŠ”±Č½Ļ£¬²ąÖŲѧɜµÄ·ÖĪö”¢¼ĘĖćÄÜĮ¦µÄ漲飬Ć÷Č·Ķ¼ĻóÖŠĒśĻß±ä»ÆµÄŗ¬ŅåĪŖ½ā“š¹Ų¼ü£¬øł¾ŻĶ¼ĻóÕĘĪÕĘ½ŗā³£ŹżµÄÓ¦ÓĆĪŖ½ā“šøĆĢāµÄ¹Ų¼ü£¬ÄѶČÖŠµČ£®


 Ņ»æĪŅ»Į·æĪŹ±“ļ±źĻµĮŠ“š°ø
Ņ»æĪŅ»Į·æĪŹ±“ļ±źĻµĮŠ“š°ø ĘŚÄ©±¦µäµ„ŌŖ¼ģ²ā·ÖĄąø“Ļ°¾ķĻµĮŠ“š°ø
ĘŚÄ©±¦µäµ„ŌŖ¼ģ²ā·ÖĄąø“Ļ°¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Zµ„ÖŹ»¹ŌŠŌ“óÓŚYµ„ÖŹ | |
| B£® | XµÄĒā»ÆĪļ·ŠµćøßÓŚWµÄĒā»ÆĪļ | |
| C£® | ½öŗ¬X”¢YĮ½ŌŖĖŲµÄ»ÆŗĻĪļ¾łÖ»ŗ¬Ąė×Ó¼ü | |
| D£® | ÉĻŹöĖÄÖÖŌŖĖŲŠĪ³ÉµÄ¼ņµ„Ąė×ÓÖŠ£¬XĄė×Ó°ė¾¶×īŠ” |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
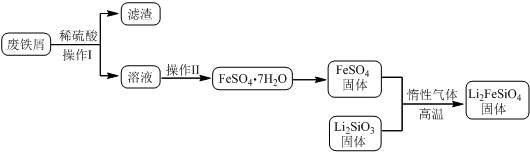
 ijŠ£»ÆѧŠĖȤŠ”×éĢ½¾æSO2ÓėFeCl3ČÜŅŗµÄ·“Ó¦£¬ĖłÓĆ×°ÖĆČēĶ¼ĖłŹ¾£Ø¼Š³ÖŅĒĘ÷ŅŃĀŌČ„£©£®
ijŠ£»ÆѧŠĖȤŠ”×éĢ½¾æSO2ÓėFeCl3ČÜŅŗµÄ·“Ó¦£¬ĖłÓĆ×°ÖĆČēĶ¼ĖłŹ¾£Ø¼Š³ÖŅĒĘ÷ŅŃĀŌČ„£©£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | “Óŗ£Ė®ÖŠĢįČ”ä唢µā¶¼Éę¼°ÖĆ»»·“Ó¦£¬“ÓæóĪļÖŹÖŠ»ńČ”ĀĮ”¢Ģś”¢Ķ”¢¹č¶¼²»Éę¼°ÖĆ»»·“Ó¦ | |
| B£® | ĄūÓĆČܽā¶ČŹż¾ŻæÉĶĘ²ā½«Ņ»Š©»ģŗĻĪļÖŹ·ÖĄėæŖĄ“µÄæÉÄÜŠŌ£¬ĄūÓĆŌ×Ó°ė¾¶Źż¾ŻæÉĶĘ²āijŠ©Ō×ÓµÄŃõ»ÆŠŌŗĶ»¹ŌŠŌµÄĒæČõ | |
| C£® | ŅņĪŖŹ³ŃĪÄÜŹ¹Ļø¾ś±äŠŌ£¬ĖłŅŌæÉŅŌÓĆŹ³ŃĪĖ®É±ĖĄH7N9ĒŻĮ÷øŠ²”¶¾ | |
| D£® | ij·“Ó¦µÄ”÷H£¾0”¢”÷S£¼0£¬ŌņøĆ·“Ó¦Ņ»¶Ø²»ÄÜÕżĻņ½ųŠŠ |
²éæ““š°øŗĶ½āĪö>>
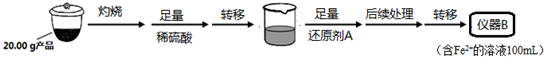
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ŹµŃéŠņŗÅ | 1 | 2 | 3 | 4 |
| ĻūŗÄKMnO4ČÜŅŗĢå»ż | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
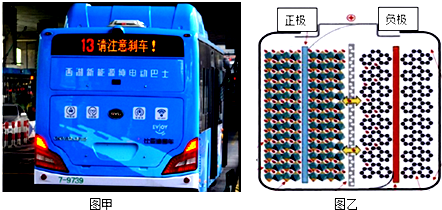
| A£® | ³äµēŹ±Ńō¼«·“Ó¦æɱķŹ¾ĪŖLiFePO4-xe-=Li1-xFePO4+xLi+ | |
| B£® | ³äµēŹ±Ņõ¼«·“Ó¦æɱķŹ¾ĪŖxLi++xe-+6C=LixC6 | |
| C£® | ·ÅµēŹ±øŗ¼«·“Ó¦æɱķŹ¾ĪŖLixC6-xe-=xLi++6C | |
| D£® | ·ÅµēŹ±Li+“Ó×óĻņÓŅĶعżĄė×Ó½»»»Ä¤ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1molC60F60·Ö×ÓÖŠ·Ē¼«ŠŌ¹²¼Ū¼üŹżÄæĪŖ60NA | |
| B£® | 2.1gDTO·Ö×ÓÖŠĖłŗ¬ÖŠ×ÓŹżĪŖNA | |
| C£® | 4.6gN2O4ŗĶNO2»ģŗĻĪļÖŠŗ¬µÄµē×ÓŹżĪŖ2.3NA | |
| D£® | aml1mol/LµÄH2BČÜŅŗÖŠ£¬²āµĆČÜŅŗÖŠĪŽH2B·Ö×Ó£¬ŌņČÜŅŗÖŠŅõĄė×ÓŹżĪŖaNA |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com