
①_________________________________________,__________________________;
②_________________________________________,______________________________;
③________________________________________,_______________________________;
④_________________________________________,______________________________。
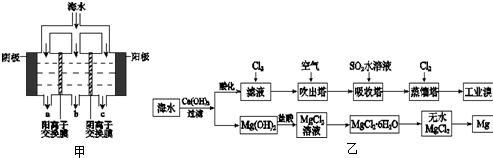
解析:生成MgCl2的途径很多,如:
Mg![]() MgCl2 Mg
MgCl2 Mg![]() MgCl2
MgCl2
MgO![]() MgCl2 Mg(OH)2
MgCl2 Mg(OH)2![]() MgCl2
MgCl2
MgCO3![]() MgCl2 Mg(HCO3)2
MgCl2 Mg(HCO3)2![]() MgCl2
MgCl2
MgSO4![]() MgCl2 ……
MgCl2 ……
其中Mg+Cl2===MgCl2不属于离子反应。改写的关键是熟知MgO、Mg(OH)2、MgCO3的溶解性。
答案:①Mg+2HCl===MgCl2+H2↑
Mg+2H+===Mg2++H2↑
②MgO+2HCl===MgCl2+H2O
MgO+2H+===Mg2++H2O
③Mg(OH)2+2HCl===MgCl2+2H2O
Mg(OH)2+2H+===Mg2++2H2O
④MgCO3+2HCl===MgCl2+CO2↑+H2O
MgCO3+2H+===Mg2++CO2↑+H2O


科目:高中化学 来源: 题型:
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42 | 2560 | Br- | 64 |
| Mg2+ | 1272 |
查看答案和解析>>
科目:高中化学 来源: 题型:
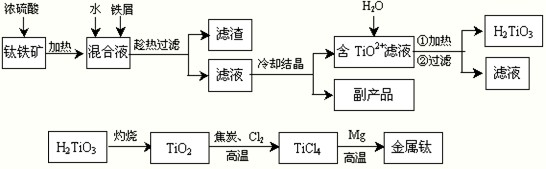
 H2TiO3+2H+
H2TiO3+2H+ H2TiO3+2H+
H2TiO3+2H+
| ||
| c(TiCl4)×c2(CO) |
| c2(Cl2) |
| c(TiCl4)×c2(CO) |
| c2(Cl2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 成分 | 含量(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com