
下列溶液中氯离子浓度与50mL 1mol/L的AlCl3溶液中氯离子浓度相等的是()
A. 150mL 1mol/L的NaCl B. 75mL 2mol/L的NH4Cl
C. 150mL 3mol/L的KCl D. 75mL 2mol/L的CaCl2
考点: 物质的量浓度.
专题: 物质的量浓度和溶解度专题.
分析: 根据化学式可知1mol•L﹣1的AlCl3溶液中氯离子浓度为3mol/L,结合各选项中化学式判断溶液中氯离子浓度,注意离子的浓度与溶液的体积无关,与物质的构成有关.
解答: 解:1mol•L﹣1的AlCl3溶液中氯离子浓度为:3mol/L.
A、150 mL 1 mol•L﹣1的NaCl溶液中,氯离子浓度为:1 mol•L﹣1,故A错误;
B、75 mL 2 mol•L﹣1的NH4Cl溶液中,氯离子浓度为:2mol/L,故B错误;
C、150 mL 3 mol•L﹣1的KCl溶液中,氯离子浓度为:3mol/L,故C正确;
D、75mL 2 mol•L﹣1的CaCl2溶液中氯离子浓度为:4mol/L,故D错误;
故选C.
点评: 本题考查了物质的量浓度的计算,题目难度较小,明确物质的构成是解答本题的关键,并注意注意离子的浓度与溶液的体积无关,与物质的构成有关.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
下列反应不属于取代反应的是()
A. 溴乙烷与氢氧化钠水溶液共热
B. 溴乙烷与氢氧化钠的乙醇溶液共热
C. 苯与液溴的反应
D. 乙炔与氯化氢制氯乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,反应H2(g)+I2(g)⇌2HI(g)△H<0,在带有活塞的密闭容器中达到平衡,下列说法中正确的是()
A. 容器体积不变,升温正反应速率减小
B. 温度、压强均不变,充入HI气体,开始时正反应速率增大
C. 温度不变,压缩气体的体积,平衡不移动,颜色加深
D. 容器体积、温度不变,充入氦气后,正反应速率将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列仪器:①容量瓶,②蒸馏烧瓶,③漏斗,④燃烧匙,⑤天平,⑥分液漏斗,⑦胶头滴管,常用于混合物质分离的是()
A. ①③⑤ B. ②④⑦ C. ①②⑥ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
在相同的温度和压强下,4个容器中分别装有4种气体.已知各容器中的气体和容器的容积分别是a.CO2,100mL;b.O2,200mL;c.N2,400mL;d.CH4,600mL,则4个容器中气体的质量由大到小的顺序是()
A. a>b>c>d B. b>a>d>c C. c>d>b>a D. d>c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下有①6.72L CH4 ②3.01×1023个 HCl分子③13.6g H2S,下列对这三种气体的关系从小到大的排列顺序是:(填写序号)
A、物质的量①③② B、体积①③② C、质量①③② D、氢原子数②③①.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法中正确的是()
A. 从组成元素上可以区别纯净物和混合物
B. 往Fe(OH)3胶体中逐滴加入稀硫酸会产生沉淀而后沉淀逐渐溶解
C. 通过化学变化可以实现16O与18O问的相互转化
D. 鸡蛋清溶液中加入饱和(NH4)2SO4溶液生成白色沉淀,属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各实验装置的叙述中,不正确的是()
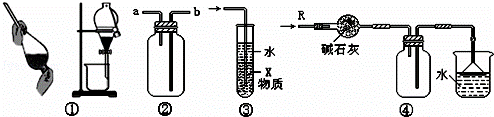
A. 装置①可用于分离C2H5OH和H2O的混合物
B. 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C. 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D. 装置④可用于干燥、收集NH3,并吸收多余的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组为了变废为宝,拟采用铅铬黄法对某电镀厂含铬废水进行处理,并生产出符合条件的铅铬黄(PbCrO4).设计实验如下:
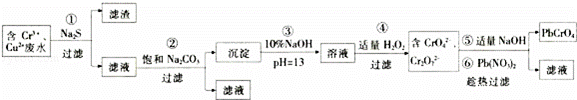
已知:a.该厂的废水中主要含Cr3+,还有少量Cu2+和其它可溶性杂质;
b.Cr(OH)3不溶于水,具有两性,pH=13时,发生反应:Cr(OH3)+OH﹣=﹣
回答下列问题:
(1)滤渣的成分是 (填化学式);第②步加入Na2CO3溶液的作用是 .
(2)第④步生成CrO42﹣的离子方程式为 .
(3)第⑤步加入NaOH的目的是为了提高铅铬黄的产率,请用化学平衡移动原理加以解释: .
(4)测定铅铬黄纯度:取mg铅铬黄样品溶解,加足量KI将其还原为Cr3+,再用 c mol•L﹣1 Na2S2O3标准液滴定(反应:2Na2S2O3+I2=Na2S4O6+2NaI),消耗体积VmL.该滴定实验中所需主要玻璃仪器有烧杯、 ,测定标准液体积的仪器事先进行洗涤所用试剂依次为 ;此铅铬黄样品的质量分数w=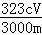 (用含c、m和V的式子表示).
(用含c、m和V的式子表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com