
【题目】CuSO4溶液是中学化学及工农业生产中常见的一种试剂。
(1)某同学配制CuSO4溶液时,向盛有一定量硫酸铜晶体的烧杯中加入适量的蒸馏水,并不断搅拌,结果得到悬浊液。他认为是固体没有完全溶解,于是对悬浊液加热,结果发现浑浊更明显了。原因是(用离子方程式和简要文字说明表示)___________________________,最后,他向烧杯中加入了一定量的_________________溶液,得到了澄清的CuSO4溶液。
(2)该同学利用制得的CuSO4溶液,进行了以下实验探究。
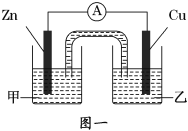
①图一是根据反应Zn+CuSO4═Cu+ZnSO4设计成的锌铜原电池。电解质溶液乙是______溶液,Cu极的电极反应式是____________________。
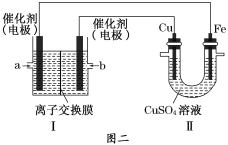
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为NaOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则Fe电极为__________(填“阳极”或“阴极”)。若铜电极的质量减轻3.2 g,则消耗的CH4在标准状况下的体积为___________L。
【答案】Cu2++2H2O![]() Cu(OH)2+2H+,升高温度水解程度增大,产生更多难溶性的Cu(OH)2 H2SO4 CuSO4 Cu2++2e-=Cu 阴极 0.28L
Cu(OH)2+2H+,升高温度水解程度增大,产生更多难溶性的Cu(OH)2 H2SO4 CuSO4 Cu2++2e-=Cu 阴极 0.28L
【解析】
(1)硫酸铜是强酸弱碱盐,在硫酸铜溶液中,铜离子水解产生Cu(OH)2和硫酸,使得溶液显酸性;
(2)①负极为Zn,电解质溶液中含锌离子;Cu为正极,铜离子得到电子发生还原反应;
②铁上镀铜,则Cu为阳极,Fe为阴极,Cu电极与b相连,b为原电池的正极,a为负极,据此解答。
(1) 硫酸铜是强酸弱碱盐,在硫酸铜溶液中,Cu2+发生水解反应,消耗水电离产生的OH-,促进了水的电离,水解的离子方程式为:Cu2++2H2O![]() Cu(OH)2+2H+,水解生成氢氧化铜在水中溶解度小,使得溶液变浑浊,由于水解反应是吸热反应,所以升高温度,水解平衡右移,因此看到浑浊更明显了;由于水解使溶液显酸性,根据平衡移动原理,同时不能引入杂质,则可以加入少量硫酸来抑制盐的水解;
Cu(OH)2+2H+,水解生成氢氧化铜在水中溶解度小,使得溶液变浑浊,由于水解反应是吸热反应,所以升高温度,水解平衡右移,因此看到浑浊更明显了;由于水解使溶液显酸性,根据平衡移动原理,同时不能引入杂质,则可以加入少量硫酸来抑制盐的水解;
(2)①根据反应Zn+CuSO4═Cu+ZnSO4可知:Zn在反应中失去电子,被氧化,所以Zn为负极,电解质溶液中的Cu2+得电子生成铜,Cu为正极,Cu2+在正极上得到电子发生还原反应;电极反应式为Cu2++2e-=Cu,所以电解质溶液乙为CuSO4溶液;
②铁上镀铜,则Fe为阴极,Fe电极上发生的反应为:Cu2++2e-=Cu;与Fe电极连接的a为负极,a处通入CH4气体,CH4失去电子,发生氧化反应,由于电解质溶液为碱性,所以负极的电极反应式为:CH4-8e-+10OH-=CO32-+7H2O;Cu为阳极,Cu电极上发生的反应为:Cu-2e-=Cu2+,Cu电极与b相连,b为原电池的正极,即b处通入O2,若铜电极的质量减轻3.2 g,n(Cu)=3.2g÷64g/mol=0.05mol,n(e-)=0.05mol×2=0.10mol,在整个闭合回路中电子转移数目相等,根据负极电极反应式CH4-8e-+10OH-=CO32-+7H2O可知:1molCH4反应失去8mol电子,则反应转移0.1mol电子,消耗甲烷的物质的量为n(CH4)=0.1mol÷8=0.0125mol,则消耗的CH4在标准状况下的体积为V=0.0125mol×22.4L/mol=0.28L。


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
【题目】某结晶水合物的化学式为 RnH2O,其相对分子质量为 M。25 ℃时,a g 该晶体能够溶 于 b g 水中形成 V mL 饱和溶液。下列关系中不正确的是( )
A.该溶液中溶质的质量分数为 w=![]()
B.该溶液的物质的量浓度为 c=![]()
C.25 ℃时 R 的溶解度为 S= ![]() g
g
D.该溶液的密度为 ρ=![]() g/mL
g/mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积固定为a L的密闭容器中充入1 mol X气体和2 mol Y气体,发生反应X(g)+2Y(g)![]() 2Z(g),此反应达到平衡状态的标志是
2Z(g),此反应达到平衡状态的标志是
A. 容器内气体密度不随时间变化
B. 容器内气体的平均相对分子质量不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2
D. 消耗0.1 mol X的同时生成0.2 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为 M 的气态化合物 V L(标准状况),溶于 m g 水中,得到质量分数为 w、物质的量浓度为 c mol/L、密度为 ρg/mL 的溶液,下列说法正确的是
A.相对分子质量![]() B.物质的量浓度
B.物质的量浓度![]()
C.溶液的质量分数![]() D.溶液密度
D.溶液密度![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. SO2![]() CaSO3
CaSO3![]() CaSO4
CaSO4
B. Fe![]() Fe2O3
Fe2O3![]() FeCl3
FeCl3
C. HCl(aq)![]() Cl2
Cl2![]() Ca(ClO)2
Ca(ClO)2
D. Cu2(OH)2CO3![]() CuO
CuO![]() CuCl2(aq)
CuCl2(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是( )
A. 现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体的物质的量之比为3∶2∶1
B. 28 g CO和22.4 L CO2中含有的碳原子数一定相等
C. 标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D. a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向仅含SO![]() 、I-、Br-且物质的量分别为m、n、6 mol 的钠盐溶液中通入适量氯气,溶液中这三种离子的物质的量的变化如图所示。下列说法中正确的是( )
、I-、Br-且物质的量分别为m、n、6 mol 的钠盐溶液中通入适量氯气,溶液中这三种离子的物质的量的变化如图所示。下列说法中正确的是( )
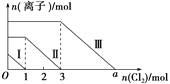
A. 曲线Ⅱ代表Br-的变化情况
B. 曲线Ⅰ对应的反应:SO![]() +Cl2+H2O===2H++SO
+Cl2+H2O===2H++SO![]() +2Cl-
+2Cl-
C. 通入的氯气为5 mol时,溶液中的主要阴离子为Cl-、SO![]()
D. 溶液中n(Na+)=n(SO![]() )+n(I-)+n(Br-)
)+n(I-)+n(Br-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbI2(亮黄色粉末)是生产新型敏化太阳能电池的敏化剂——甲胺铅碘的原料。合成PbI2的实验流程如图1:
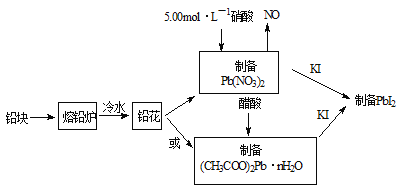

(1)将铅块制成铅花的目的是_____________。
(2)31.05g铅花用5.00mol·L-1的硝酸溶解,至少需消耗5.00 mol·L-1硝酸_______mL。
(3)取一定质量(CH3COO)2Pb·nH2O样品在N2气氛中加热,测得样品固体残留率)(![]() )随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水)。
)随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水)。
①(CH3COO)2Pb·nH2O中结晶水数目n=__________(填整数)。
②100~200℃间分解产物为铅的氧化物和一种有机物,则该有机物为___________(写分子式)。
(4)称取一定质量的PbI2固体,用蒸馏水配制成室温时的饱和溶液,准确移取25.00mL PbI2饱和溶液分次加入阳离子交换树脂RH中,发生:2RH(s) + Pb2+(aq) = R2Pb(s) +2H+(aq),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液合并到锥形瓶中。加入2~3滴酚酞溶液,用0.002500mol·L-1NaOH溶液滴定,到滴定终点时用去氢氧化钠标准溶液20.00mL。则室温时PbI2的Ksp为___________。
(5)探究浓度对磺化铅沉淀溶解平衡的影响。
该化学小组根据所提供试剂设计两个实验,来说明浓度对沉淀溶解平衡的影响。
提供试剂:NaI饱和溶液、NaCl饱和溶液、FeCl3饱和溶液、PbI2饱和溶液、PbI2悬浊液。
信息提示:Pb2+和Cl-能形成较稳定的PbCl42-络离子。
请填写下表的空白处:
实验内容 | 实验方法 | 实验现象及原因分析 |
①磺离子浓度增大对平衡的影响 | 取PbI2饱和溶液少量于一支试管中,再滴入几滴NaI饱和溶液 | 现象:溶液中c(I-)增大,使Q大于了PbI2的Ksp |
②铅离子浓度减小对平衡的影响 | ________ | 现象:________ 原因:________ |
③________ | 在PbI2悬浊液中滴入几滴FeCl3饱和溶液 | 现象:黄色浑浊消失 ________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com