

| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
| ||
| ||
| (21.03-1.04)+(21.99-1.98) |
| 2 |
5×10-4mol×160g/mol×
| ||
| 1.000g |
| Ksp |
| c(Fe2+) |
|


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中 各元素原 子个数比 | A:C= 1:1 | B:C= 1:2 | D:E= 1:3 | B:E= 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在元素周期表中的前四周期,两两相邻的5种元素如图所示,若B元素的核电荷数为a.下列说法正确的是( )
在元素周期表中的前四周期,两两相邻的5种元素如图所示,若B元素的核电荷数为a.下列说法正确的是( )| A、B、D的原子序数之差可能为2 |
| B、E、B的原子序数之差可能是8、18或32 |
| C、5种元素的核电荷总数之和可能为5a+10 |
| D、A、E的原子序数之差可能是7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
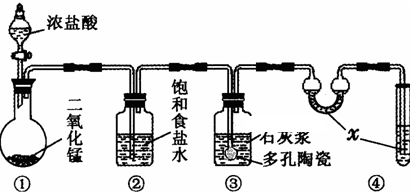
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质结构信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com