
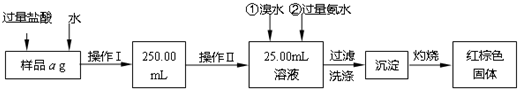
分析 本实验目的是测定铁的质量分数,采取的方法是使样品溶解、将亚铁离子氧化成铁离子、加入氨水使铁离子沉淀,过滤将所得氢氧化铁灼烧最终生成氧化铁,然后通过氧化铁质量来求铁的质量分数,
(1)氯化亚铁和氯化铁的混合物溶于水时,铁离子水解会产生成氢氧化铁,所以加盐酸可以抑制其水解,操作Ⅰ是配制250mL溶液,操作中是从配制得的溶液中精确量取25mL溶液,据此判断仪器;
(2)加入氨水主要作用是将铁离子生成氢氧化铁沉淀,根据电荷守恒和元素书写离子方程式;
(3)沉淀洗涤的方法是向过滤器中加蒸馏水至沉淀表面浸没,自然滤出,重复此操作2-3次;
(4)两次连续称量的质量相差不能超过0.1g才能说明分解完全,故应继续加热并称量;加热分解所得的物质是Fe2O3,其质量为(W2-W1)g,由于去25mL溶液,故250mL溶液可以得到Fe2O3质量为10(W2-W1)g,根据化学式计算铁元素的质量,再利用质量分数的定义计算原氧化铁样品中铁元素的质量分数.
解答 解:(1)氯化亚铁和氯化铁的混合物溶于水时,铁离子水解会产生成氢氧化铁,所以加盐酸可以抑制其水解,操作Ⅰ是配制250mL溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有胶头滴管和250 mL容量瓶,操作中是从配制得的溶液中精确量取25mL溶液,所以要用酸式滴定管或移液管,
故答案为:抑制亚铁离子和铁离子的水解;胶头滴管和250 mL容量瓶; 酸式滴定管或移液管;
(2)加入氨水主要作用是将铁离子生成氢氧化铁沉淀,反应的离子方程式为Fe3++3NH3+3H2O=Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3+3H2O=Fe(OH)3↓+3NH4+;
(3)沉淀洗涤的方法是向过滤器中加蒸馏水至沉淀表面浸没,自然滤出,重复此操作2-3次,
故答案为:向过滤器中加蒸馏水至沉淀表面浸没,自然滤出,重复此操作2-3次;
(4)两次连续称量的质量相差不能超过0.1g才能说明分解完全,故应继续加热并称量,
250mL溶液可以得到Fe2O3质量为10(W2-W1)g,铁元素的质量为10(W2-W1)g×$\frac{112}{160}$=7(W2-W1)g,所以原氧化铁样品中铁元素的质量分数$\frac{7(W{\;}_{2}-{W}_{1})}{a}$,
故答案为:继续加热,冷却至室温时,称量,直至两次连续称量质量差不超过0.1g;$\frac{7(W{\;}_{2}-{W}_{1})}{a}$.
点评 本题考查溶液配制、沉淀的洗涤、对实验操作的理解与实验方案的评价、化学计算等,难度中等,清楚测定原理是解题的关键,是对所学知识的综合运用,需要学生具有扎实的基础与运用知识分析解决问题的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极的电极反应式为:O2+4H++4e-═2H2O | |
| B. | 溶液中阴离子向正极移动 | |
| C. | 负极的电极反应式为:N2H4+4OH--4e-═4H2O+N2 | |
| D. | 电解质溶液的pH保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
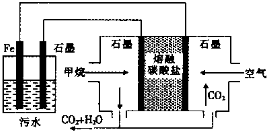
| A. | 左侧装置中的铁电极可换成石墨电极 | |
| B. | 通入甲烷的石墨电极的电极反应式为:CH4+4CO32--8e-═5CO2+2H2O | |
| C. | 通入空气的石墨电极做正极,发生氧化反应 | |
| D. | 若左侧装置中石墨电极产生标准状况下气体44.8L气体,则消耗2mol甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:3:2 | B. | 5:5:4 | C. | 2:2:3 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的质量为$\frac{24b-a}{9}$g | |
| B. | c1=$\frac{{c}_{2}{V}_{2}}{{V}_{1}}$ | |
| C. | d=a+34b | |
| D. | 与金属反应后剩余盐酸为(c1V1-2b)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水中滴加石蕊试液显蓝色 | |
| B. | NO2通入水中,气体由红棕色逐渐转变为无色 | |
| C. | 萃取时向碘水中滴加适量的稀盐酸,有透明的凝胶形成 | |
| D. | 向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 古铜币上出现铜绿[Cu2(OH)2CO3] | B. | 铝制用品表面变暗 | ||
| C. | 钢铁生锈 | D. | 氢氧化钠固体潮解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com