
【题目】标出下列氧化还原反应中电子转移的方向和数目____________
![]()
该反应的还原产物是______________;____________元素被氧化;若反应有![]() 电子发生转移,则被还原的氧化剂是_________mol。
电子发生转移,则被还原的氧化剂是_________mol。
科目:高中化学 来源: 题型:
【题目】回答下列问题
学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理请回答下列问题:
(1)常温下,某纯碱溶液中滴入酚酞,溶液呈红色,则该溶液呈 ______性,原因是________________;用离子方程式表示
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于 ______________;
(3)已知在H2S溶液中存在下列平衡: H2S![]() H++HS-
H++HS-
向H2S溶液中加入NaOH固体时,不考虑温度变化电离平衡向______移动,填“左”或“右”),c(H+)______。(填“增大”、“减小”或“不变”
向H2S溶液中加入NaHS固体时,电离平衡向______移动,填“左”或“右”)c(S2—)______。(填“增大”、“减小”或“不变”)

(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 ______ 填“A”或“B”;设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1______ m2。 (选填“![]() ”、“
”、“![]() ”、“
”、“![]() ”
”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成份CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3和ZnSO4溶液的一种工艺流程如下:
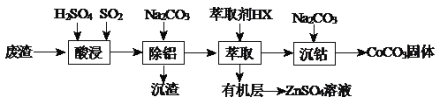
下表是相关金属离子生成氢氧化物沉淀的pH(按金属离子浓度为1.0mol·L-1计算):
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸浸”时发生氧化还原反应的化学方程式________________________。
(2)“除铝”过程中需要调节溶液pH的范围为_________,形成沉渣时发生反应的离子方程式为______________________。
(3)在实验室里,萃取操作用到的玻璃仪器主要有_________________;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______________。
(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因___________________。
(5)在空气中煅烧CoCO3生成某种钴氧化物和CO2,若充分煅烧一定量CoCO3后测定所得固体质量为2.41g,CO2的体积为0.672L(标准状况),假设固体为纯净物,其化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-有机化学基础】利用从冬青中提取的有机物A合成结肠炎药物及其它化学品,合成路线如下:

根据上述信息回答:
(1)D不与NaHCO3溶液反应,D中官能团的名称是__________。B→C的反应类型是______。
(2)写出A生成B和E的化学反应方程式__________________。
(3)A的同分异构体I和J是重要的医药中间体,在浓硫酸的作用下I和J分别生成 ,鉴别I和J的试剂为______________________。
,鉴别I和J的试剂为______________________。
(4)A的另一种同分异构体K用于合成高分子材料K可由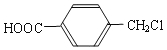 制得,写出K在浓硫酸作用下生成的聚合物的结构简式:__________________。
制得,写出K在浓硫酸作用下生成的聚合物的结构简式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里可用如下图所示的装置制取氯酸钾、次氯酸钠,并验证氯水的性质。
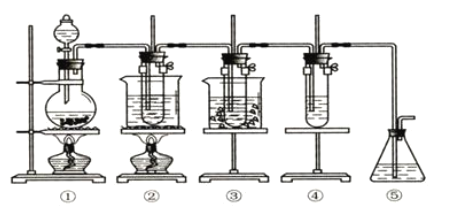
图中①为氯气发生装置,②的试管中盛有![]() 的
的![]() 溶液,并置于热水浴中,③的试管中盛有
溶液,并置于热水浴中,③的试管中盛有![]() 的
的![]() 溶液,并置于冰水浴中,④的试管中加有紫色石蕊试液,⑤为尾气吸收装置。
溶液,并置于冰水浴中,④的试管中加有紫色石蕊试液,⑤为尾气吸收装置。
(1)制取氯气时,在烧瓶中先加入一定量的二氧化锰固体,再通过_________(填写仪器名称)向烧瓶中加入适量的____________(填写试剂名称)。
(2)为除去氯气中混有的氯化氢气体,可在①和②之间安装盛有__________(选填字母编号)的净化装置。
a.碱石灰 b.饱和食盐水 c.浓硫酸 d.饱和碳酸氢钠溶液
(3)本实验制取次氯酸钠的离子方程式是____________________。
(4)比较制取氯酸钾和次氯酸钠的条件,可以初步得到的结论是__。
(5)反应完毕经冷却后,②的试管中有大量晶体析出,图中符合该晶体溶解度随温度变化规律的曲线是___________(选填字母);从②的试管中分离该晶体的操作是___________(填写实验操作名称)。

(6)实验中可观察到④的试管中溶液颜色会发生变化:最初溶液由紫色变为_________,随后溶液逐渐变为无色,是因为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. CH4,C2H2,HCN都是含有极性键的非极性分子
B. CO2与SO2的立体构型相似,都是非极性分子
C. ![]() 分子中含有1个手性碳原子
分子中含有1个手性碳原子
D. 无机含氧酸分子中有几个氢原子,它就属于几元酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中溶质的物质的量浓度为1mol·L-1的是( )
A.将0.1mol胆矾固体溶于100mL水中
B.将22.4LHCl气体溶于水配成1L溶液
C.将1L10mol·L-1的浓盐酸与9L水混合
D.10gNaOH固体溶解在水中配成250mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离常数如表所示:
化学式 | CH3COOH | H2CO3 |
电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
请回答下列问题:
(1)相同pH的CH3COONa、NaHCO3、Na2CO3浓度由大到小的顺序为__________
(2)常温下0.1mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母,下同)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(H+)/c(OH-)
(3)现有10mLpH=2的盐酸溶液,进行以下操作:
a.与pH=5的盐酸等体积混合,则pH=_____________;
b.向该盐酸溶液中加入10mL0.02mol/LCH3COONa溶液,则该混合溶液中存在的物料守恒式为__________________;
c.向该盐酸溶液中加入等体积等浓度的Na2CO3溶液,则混合溶液中存在的电荷守恒式为_______________________;
d. 下列关于体积都为10mL,pH=2的A(盐酸)和B(CH3COOH)溶液说法正确的是_____ (填写序号)。
①与等量的锌反应开始反应时的速率A=B
②与等量的锌反应(锌完全溶解,没有剩余)所需要的时间A>B
③加水稀释100倍,pH大小比较:4=A>B>2
④物质的量浓度大小比较:A>B
⑤分别与10mLpH=12的NaOH溶液充分反应后的溶液pH大小比较:A<B
e. 现用标准HCl溶液滴定氨水,应选用________指示剂,下列操作会导致测定结果偏高的是___。
A.未用HCl标准溶液润洗滴定管
B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com