
甲、乙、丙三种元素均位于第三周期,其原子序数逐渐增大,甲的最高价氧化物对应的水化物是强碱,乙是地壳中含量最多的金属元素,丙是本周期中原子半径最小的元素。下列说法不正确的是
A.甲是第IA元素,丙是第VIIA元素
B.甲、丙形成的化合物是离子化合物
C.乙的最高价氧化物是两性氧化物
D.丙是元素周期表中非金属性最强的元素
 目标测试系列答案
目标测试系列答案科目:高中化学 来源:2014-2015广东省高二上学期期中联考化学(文)试卷(解析版) 题型:?????
某学生用化学知识解决生活中的问题,下列家庭小实验不合理的是
A.用食醋除去暖水瓶中的薄层水垢
B.用米汤检验食盐中是否含碘酸钾(KIO3)
C.用纯碱(Na2CO3)溶液洗涤餐具上的油污
D.用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省汕头市高一上学期10月月考化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值。下列说正确的是
A.高温下,0.2molFe与足量稀硫酸反应反应,生成的H2分子数目为0.3NA
B.78g过氧化钠中含阴离子数为2 NA
C.C2H4和N2组成的42g混合气体中原子的个数为3 NA
D.5NH4 NO3 2HNO3 + 4N2↑+ 9H2O反应中,生成28gN2 时,转移的电子数目为3.75NA
2HNO3 + 4N2↑+ 9H2O反应中,生成28gN2 时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省江南十校高三上学期期末联考理综化学试卷(解析版) 题型:填空题
(16分)聚乙酸乙烯酪广泛用于制备涂料、粘合剂等,它和高聚物长的合成路线如下:
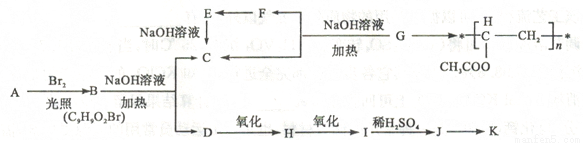
其中J物质与氯化铁溶液能发生显色反应,且苯环上的一元取代物原有两种。
已知①当羟基与双键碳原子相连时,易发生如下转化RCH =CHOH→RCH2CHO
②一ONa连在烃基生不会被氧化
请回答下列问题:CH3COO CH3 CH2Br
(1)写出G的结构简式 。F与H中具有相同官能团的名称 。
(2)上述变化中G→C+F 的反应类型是 ;J在一定条件下能生成高聚物K,K的结构简式是 。
(3)写出B→C+D反应的化学方程式: 。
(4)同时符合下列要求的A的同分异构体有 种。
I含有苯环
II能发生银镜反应和水解反应
并写出满足下列条件的同分异构体结构简式: 。
①核磁共振氢谱有5 个吸收峰
②1mol该同分异构体能与Imol NaOH 反应
(5)下列有关说法正确的是 。
a.1 mol A 完全燃烧消耗10.5 mol O2
b.J与足量的碳酸氢钠溶液反应能生成相应的二钠盐
c.D→H 的试剂通常是KMO4 酸性溶液
d.J能发生加成、消去、取代、氧化等反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省江南十校高三上学期期末联考理综化学试卷(解析版) 题型:选择题
室温下,下列各组粒子在指定溶液中能大量共存的是
A.Ba(NO3)2 溶液中:SO2、Na+、NH4+、CH3COO-
B.Kw/c(H+)=0.1mol/L的溶液中:K+、Ba2+、C1-、HCO—
C.FeCl2溶液中:H2O2、Mg2+、H+、Cl-
D.含苯酚的水溶液中用::Al3+、NH4+、Br-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三上学期期末考试化学试卷(解析版) 题型:选择题
能用溴水鉴别的是
A.甲烷、乙烯 B.甲烷、乙烷
C.NaCl溶液、KCl溶液 D.MgSO4溶液、Mg(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源:2015年湖北省荆门市高三元月调考理综化学试卷(解析版) 题型:实验题
(14分)肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。CO(NH2) + 2NaOH + NaClO = Na2CO3 + N2H4·H2O + NaCl
实验一:制备NaClO溶液
(1)将氯气通入到盛有NaOH的锥形瓶中,锥形瓶中发生反应的离子方程式是 ;
实验二:制取水合肼(实验装置如图所示)

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O + 2NaClO=N2↑ + 3H2O + 2NaCl)
(2)分液漏斗中的溶液是 (填标号A或B);
A.NaOH和NaClO混合溶液
B.CO (NH2) 2溶液
选择的理由是 ;
实验三:测定馏分中肼含量水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体,经稀释、转移、定容等步骤,配制250mL溶液。
b.移取25.00 mL于锥形瓶中,加入10mL水,摇匀.
c.用0.2000mol/L碘溶液滴定至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右。记录消耗碘的标准液的体积。
d.进一步操作与数据处理
(3)水合肼与碘溶液反应的化学方程式 ;滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是 。
(4)滴定时,碘的标准溶液盛放在 滴定管中(选填:“酸式”或“碱式”);若本次滴定消耗碘的标准溶液为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为 (保留三位有效数字);
(5)为获得更可靠的滴定结果,步骤d中进一步操作主要是: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三一月化学试卷(解析版) 题型:选择题
实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示)。已知,固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种。若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是

A.只用盐酸一种试剂就可以确定该固体M的具体成分
B.往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3
C.往溶液中加入稀硝酸酸化的BaCl2,若有白色沉淀,则固体M为Na2SO4
D.用pH试纸检验,若常温下pH=7,则固体M一定是Na2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com