
| A. | 若向2mL 1mol/LNaOH溶液中先加入2滴1mol/L MgCl2溶液,再加入2滴1mol/L的FeCl3溶液,可以证明Mg(OH)2沉淀转化为Fe(OH)3沉淀 | |
| B. | 常温下,某溶液中由水电离出来的c(OH-)=1.0×10-12mol•L-1,则该溶液可能为盐酸,也可能为NaOH溶液 | |
| C. | 处理锅炉水垢中的CaSO4时,依次加入饱和NaCO3溶液和盐酸,水垢溶解,说明溶解度:S(CaCO3)<S(CaSO4) | |
| D. | 常温下的醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=1.0×10-7mol•L-1 |
分析 A、氢氧化钠过量,氢氧化钠和氯化镁、氯化铁反应都生成沉淀;
B、常温下,某溶液中由水电离出来的c(OH-)=1.0×10-12mol•L-1,只能说明水的电离被抑制;
C、依据沉淀容易由溶解度大的向溶解度小的转化来分析;
D、常温下的醋酸铵溶液呈中性,故有c(H+)=c(OH-),而水的离子积Kw=c(H+)•c(OH-)=1.0×10-14.
解答 解:A、氢氧化钠过量,氢氧化钠和氯化镁、氯化铁反应都生成沉淀,所以不能证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀,故A错误;
B、常温下,某溶液中由水电离出来的c(OH-)=1.0×10-12mol•L-1,只能说明水的电离被抑制,而酸和碱均能抑制水的电离,故此溶液可能为酸溶液,也可能为碱溶液,故B正确;
C、硫酸钙和碳酸钙阴离子和阳离子比相同,可以直接比较溶解度和溶度积常数,处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解,发生了沉淀转化,故C正确;
D、常温下的醋酸铵溶液呈中性,故有c(H+)=c(OH-),而水的离子积Kw=c(H+)•c(OH-)=1.0×10-14,故c(H+)=c(OH-)=1.0×10-7mol/L,故D正确.
故选A.
点评 本题考查了沉淀的转化和溶液酸碱性,应注意的是酸溶液显酸性,碱溶液显碱性,但显酸性的不一定是酸溶液,显碱性的也不一定是碱溶液.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的结构式:H-Cl-O | B. | CO2的比例模型  | ||
| C. | 氢氧根离子的电子式: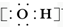 | D. | NH4Br的电子式: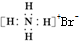 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO+H2O═CO2+H2 | B. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||
| C. | 2F2+2H2O═4HF+O2 | D. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,2mol SO2与足量O2反应可得到2mol SO3 | |
| B. | 含4mol HCl的浓盐酸与足量的MnO2加热反应可制备1mol Cl2 | |
| C. | 10mL 18.0mol/L H2SO4与足量铜加热反应可制备0.09mol SO2 | |
| D. | 一定条件下,1mol N2与3mol H2反应可制备1.0 mol NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①加CCl4 ②加苯 ③加酒精 | |
| B. | ①加酒精 ②加CCl4 ③加苯 | |
| C. | ①加苯 ②加CCl4 ③加酒精 | |
| D. | ①加苯 ②加酒精 ③加CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na和H2O | B. | Na2O和H2O | ||
| C. | Ca(OH)2和Na2CO3溶液 | D. | Ca(OH)2和NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的化合物,X可以显负价,Y显正价 | |
| B. | 第一电离能可能Y小于X | |
| C. | 最高价含氧酸的酸性:X对应的最高价含氧酸酸性弱于Y对应的最高价含氧酸的酸性 | |
| D. | 气态氢化物的稳定性:HmY小于HmX |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com