
| A. | Si可用于制造半导体材料 | |
| B. | 二氧化硫可广泛用于食品的增白 | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 84消毒液的有效成分是NaClO,可用于环境的消毒杀菌 |
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:填空题
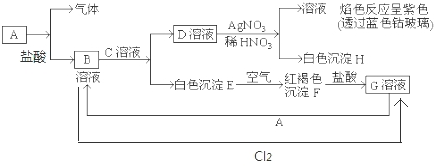
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
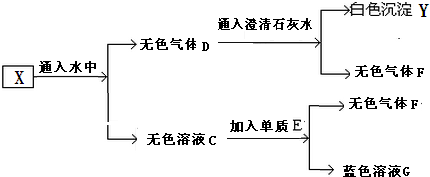
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数:Z>Y>X | B. | 单质密度:Y>X>Z | ||
| C. | 离子半径:X2->Z->Y+ | D. | 原子序数:X>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L-1 | 4×10-5 | 6×10-5 | 2×10-4 | 4×10-4 | 3×10-4 | 2×10-4 |
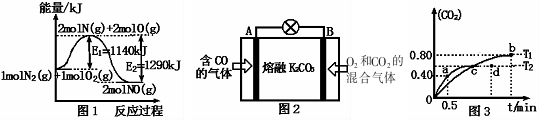
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含有1个双键的直链有机物 | B. | 含2个双键的直链有机物 | ||
| C. | 含1个双键的环状有机物 | D. | 含一个叁键的直链有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中水的离子积常数(KW)随溶液浓度的改变而改变 | |
| B. | 一般情况下,一元弱酸HA的Ka越大,表明该酸的酸性越弱 | |
| C. | 对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变 | |
| D. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com